Электрофизиология (англ. electrophysiology) – это раздел физиологии, направленный на изучение потока ионов (ионной ток) в биологических тканях и использующий методы электрической регистрации, позволяющие измерить этот ток.
Нейрональная электрофизиология направлена на изучение электрических потенциалов биологических клеток и тканей в пределах нервной системы. С помощью нейрональной электрофизиологии врачи и специалисты могут определить механизм нейрональных нарушений, по активности головного мозга человека. Например, активность какого участка мозга активируется во время определенного стимула.
Классические электрофизиологические методы
Классические методы электрофизиологии включают размещение электродов в различных препаратах биологической ткани. Основными типами электродов являются:
- простые твердые проводники, такие как диски и иглы (одиночные или массивы электродов, часто изолированные, за исключением наконечника);
- трассировки на печатных платах или гибких полимерах, также изолированные, за исключением наконечника;
- полые трубки, заполненные электролитом, такие как стеклянные пипетки, заполненные раствором хлорида калия или другим раствором электролита.
Основные подготовительные мероприятия включают в себя:
- живой организм;
- иссеченная ткань (острая или культивированная);
- диссоциированные клетки из иссеченной ткани (острые или культивированные);
- искусственно выращенные клетки или ткани;
- гибриды вышеперечисленного.
Если электрод достаточно мал (микрометры) в диаметре, то электрофизиолог может осуществлять непосредственное наблюдение и регистрацию внутриклеточной электрической активности отдельной клетки. Однако эта инвазивная установка приводит к сокращению срока жизни клетки и вызывает утечку веществ через клеточную мембрану. Внутриклеточную активность также можно наблюдать с помощью специальной (полой) стеклянной пипетки, содержащей электролит. В этом методе микроскопический наконечник пипетки прижимается к клеточной мембране, к которой он плотно прилипает в результате взаимодействия за счет контакта между стеклом и липидами клеточной мембраны. Электролит внутри пипетки может быть может быть переведен в непрерывный поток жидкости с цитоплазмой путем подачи импульса отрицательного давления на пипетку с целью разрыва небольшого участка мембраны окруженного ободком пипетки (цельноклеточная запись). Альтернативно, ионная непрерывность может быть установлена путем “перфорирования” пэтча, позволяя экзогенному порообразующему агенту внутри электролита встраиваться в мембранный пэтч (запись перфорированного пэтча). Наконец, пэтч может быть оставлен нетронутым (запись пэтча).
➥ Более подробно: Микроэлектродный метод измерения мембранного потенциала
Электрофизиолог может решить не устанавливать наконечник в одну клетку. Вместо этого наконечник электрода может быть оставлен в неразрывной связи с внеклеточным пространством. Если наконечник достаточно мал, такая конфигурация может позволить косвенное наблюдение и запись потенциалов действия от одной клетки, называемой одиночной записью. В зависимости от подготовки и точного размещения внеклеточная конфигурация может регистрировать активность нескольких соседних клеток одновременно, мультиюнитная запись.
По мере увеличения размера электрода разрешающая способность уменьшается. Более крупные электроды чувствительны только к чистой активности многих клеток, называемых локальными полевыми потенциалами. Еще более крупные электроды, такие как неизолированные иглы и поверхностные электроды, используемые в терапевтической и хирургичекой практике, чувствительны только к определенным типам синхронной активности в популяциях клеток, насчитывающих миллионы.
Другие классические электрофизиологические методы включают одноканальную запись и амперометрию.
Оптические электрофизиологические методы
Оптические электрофизиологические методы были созданы учеными и инженерами для преодоления одного из главных ограничений классических методов. Классические методы позволяют наблюдать электрическую активность приблизительно в одной точке в пределах объема ткани. Классические методы сингуляризируют распределенное явление. Интерес к пространственному распределению биоэлектрической активности побудил к разработке частиц, способных испускать свет в ответ на воздействие электрической или химической среды. Примерами могут служить чувствительные к напряжению красители и флуоресцирующие белки.
После введения одного или нескольких таких соединений в ткань посредством перфузии, инъекции или экспрессии генов можно наблюдать и регистрировать одно- или двухмерное распределение электрической активности.
Внутриклеточная запись
Внутриклеточная запись включает в себя измерение напряжения и / или тока через мембрану клетки. Для ее регистрации, кончик тонкого (острого) микроэлектрода погружают внутрь клетки так, чтобы измерить мембранный потенциал. Обычно, мембранный потенциал покоя здоровой клетки составляет от -60 до -80 мВ, а при потенциале действия мембранный потенциал может достигать +40 МВ. В 1963 году Алан Ллойд Ходжкин и Эндрю Филдинг Хаксли получили Нобелевскую премию по физиологии и медицине за вклад в понимание механизмов, лежащих в основе генерации потенциалов действия в нейронах. Их эксперименты включали внутриклеточные записи с гигантского аксона Атлантического кальмара (Loligo pealei), и были одними из первых, где применялась техника “зажима напряжения”. Сегодня большинство микроэлектродов, используемых для внутриклеточной записи, представляют собой стеклянные микропипетки, полость наконечника которых заполнена раствором, имеющим сходный ионный состав с внутриклеточной жидкостью клетки. Хлорированная серебряная проволока, вставленная в пипетку, посредством электрического поля соединяет электролит с усилителем и схемой обработки сигналов. Напряжение, измеряемое электродом, сравнивается с напряжением электрода сравнения, обычно серебряной проволоки с хлоридным покрытием, находящейся в контакте с внеклеточной жидкостью вокруг клетки. Таким образом, чем меньше наконечник электрода, тем выше его электрическое сопротивление. Электрод представляет собой некий компромисс между размером (достаточно малым, чтобы проникнуть в одну клетку с минимальным ее повреждением) и сопротивлением (достаточно низким, чтобы небольшие нейрональные сигналы можно было различить по тепловому шуму от наконечника электрода).
Вольткламп
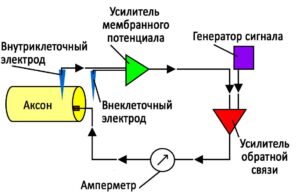
Метод “зажима напряжения” позволяет экспериментатору “зажать” потенциал клетки на выбранном значении. Это дает возможность измерения количества ионного тока, проходящего через мембрану клетки при любом заданном напряжении. Данный метод имеет большое значение, т. к. многие ионные каналы в мембране нейрона являются стробированными по напряжению ионными каналами, которые открываются только тогда, когда напряжение мембраны находится в определенном диапазоне. Измерения тока с помощью вольтклампа становится возможным благодаря почти одновременному цифровому вычитанию переходных емкостных токов, проходящих по мере зарядки регистрирующего электрода и клеточной мембраны для изменения потенциала клетки.
Токопроводящий зажим
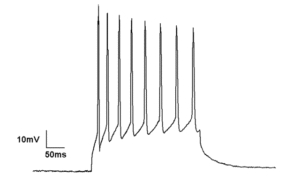
Метод токопроводящего зажима осуществляет запись мембранного потенциала при введении тока в клетку через регистрирующий электрод. В отличие от вольтклампа, когда мембранный потенциал удерживается на уровне, определяемом экспериментатором, в режиме “фиксации тока” мембранный потенциал может свободно изменяться, и усилитель регистрирует любое напряжение, которое клетка генерирует самостоятельно или в результате стимуляции. Этот метод используется для изучения реакции клетки в ответ на воздействие электрического тока на нее, например, для понимания того, как нейроны реагируют на нейромедиаторы, воздействующие на открытие мембранных ионных каналов.
Большинство усилителей с токопроводящим зажимом обеспечивают незначительное или полное отсутствие усиления изменений напряжения, регистрируемых из клетки. “Усилитель” на самом деле является электрометром, иногда называемым “усилителем с единичным коэффициентом усиления”; его основное назначение – уменьшить электрическую нагрузку на небольшие сигналы (в диапазоне МВ), производимые клетками, чтобы они могли быть точно записаны низкоомной электроникой. Усилитель увеличивает силу тока, одновременно уменьшая сопротивление, через которое этот ток проходит. Рассмотрим этот пример, основанный на законе Ома: напряжение 10 мВ генерируется при прохождении 10 наноампер тока через сопротивление 1 МОм. Электрометр изменяет этот “высокоимпедансный сигнал” на “низкоимпедансный сигнал” с помощью цепи повторителя напряжения. Повторитель напряжения считывает напряжение на входе (вызванное небольшим током через большой резистор). Затем он дает команду параллельной цепи, которая имеет большой источник тока позади него (электрическая сеть) и регулирует сопротивление этой параллельной цепи, чтобы дать то же самое выходное напряжение, но через более низкое сопротивление.
Patch clamp
➥ Основная статья:Patch clamp метод
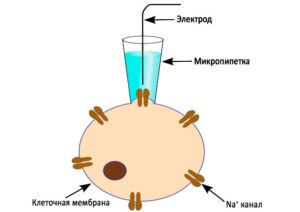
Эта методика была разработана Эрвином Нехером и Бертом Сакманом, получившими Нобелевскую премию в 1991 году. 1Обычная внутриклеточная запись включает в себя прокалывание клетки тонким электродом; пэтч кламповая запись использует другой подход. Микроэлектрод с пэтч-зажимом представляет собой микропипетку с относительно большим диаметром наконечника. Микроэлектрод располагается рядом с клеткой, и через него осуществляется легкое присасывание, чтобы втянуть кусочек клеточной мембраны (“пэтча”) в наконечник микроэлектрода; стеклянный наконечник образует высокоомное “уплотнение” с клеточной мембраной. Эта конфигурация является “клеточно-присоединенным” режимом, и ее можно использовать для изучения активности ионных каналов, присутствующих в пэтче мембраны. Если применить больше усилия при присасывании, то небольшой участок мембраны в наконечнике электрода может быть смещен, оставляя электрод герметичным для остальной части клетки. Этот “цельноклеточный” режим обеспечивает очень стабильную внутриклеточную запись. Недостатком (по сравнению с обычной внутриклеточной записью с острыми электродами) является то, что внутриклеточная жидкость клетки смешивается с раствором внутри регистрирующего электрода, по этой причине некоторые важные компоненты внутриклеточной жидкости могут быть разбавлены. Вариация этой техники, техника “перфорированного пэтча”, пытается свести к минимуму эти проблемы. Вместо всасывающего эффекта для вытеснения мембранного пэтча из наконечника электрода, применяются пэтчи с небольшими отверстиями (с помощью порообразующих агентов), для того чтобы большие молекулы, такие как белки, могли оставаться внутри клетки, а ионы могли свободно проходить через отверстия. Кроме того, участок мембраны может быть удален от остальной части клетки. Такой подход позволяет фармакологически анализировать мембранные свойства пэтча.
Запись острым электродом
В ситуациях, когда требуется зафиксировать потенциал внутри клеточной мембраны с минимальным воздействием на ионную конституцию внутриклеточной жидкости, можно использовать острый электрод. Эти микропипетки (электроды) похожи на те, что используются для фиксации пэтча, вытянутой из стеклянных капилляров, но поры гораздо меньше, так что между внутриклеточной жидкостью и электролитом в пипетке осуществляется очень слабый ионный обмен. Сопротивление микропипеточного электрода составляет десятки или сотни МОм. Часто наконечник электрода заполнен различными видами красителей, такими как Люцифер желтый чтобы заполнить клетки, для последующего подтверждения их морфологии под микроскопом. Красители вводятся путем подачи положительного или отрицательного, постоянного или импульсного напряжения на электроды в зависимости от полярности красителя.
Внеклеточная запись
Одиночная запись
➥ Основная статья: Активность одиночного нейрона
Электрод, введенный в мозг живого животного, регистрирует электрическую активность, которая генерируется нейронами, расположенными рядом с наконечником электрода. Если электрод представляет собой микроэлектрод с размером наконечника около 1 микрометра, то электрод обычно регистрирует активность не более одного нейрона. Запись таким способом называется “одиночной”. Записанные потенциалы действия очень похожи на потенциалы действия, которые записываются внутриклеточно, но сигналы очень малы (обычно около 1 мВ). Большинство записей активности отдельных нейронов у наркотизируемых и находящихся в сознании животных производится таким образом. Записи отдельных нейронов у живых животных позволили получить важные сведения о том, как мозг обрабатывает информацию. Например, Дэвид Хьюбел и Торстен Визель записали активность отдельных нейронов в первичной зрительной коре наркотизированной кошки и показали, как отдельные нейроны в этой области реагируют на специфические особенности зрительного стимула.2 Хьюбел и Визель были удостоены Нобелевской премии по физиологии и медицине в 1981 году.3
Мультиюнитная запись
Если кончик электрода имеет большие размеры, то электрод может регистрировать активность, генерируемую несколькими нейронами. Этот тип записи часто называют “мультиюнитной записью” и часто используют у животных в сознании для записи изменений активности в дискретной области мозга во время нормальной активности. Записи с одного или нескольких таких электродов, расположенных близко друг от друга, могут быть использованы для определения количества клеток вокруг него, а также того, какие из спайков исходят из какой клетки. Этот процесс называется сортировкой спайков и используется там, где есть идентифицированные типы клеток с хорошо определенными характеристиками спайка. Если наконечник электрода еще больше, то в целом активность отдельных нейронов различить невозможно, но электрод все равно сможет регистрировать потенциал поля, создаваемый активностью многих клеток.
Потенциал локального поя
➥ Основная статья: Потенциал локального поля
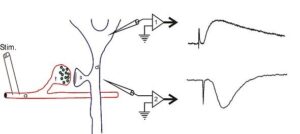
Потенциалы локального поля — это локальные стоки или источники тока, которые генерируются коллективной активностью многих клеток. Обычно потенциал локального поля генерируется одновременной активацией многих нейронов посредством синаптической передачи. На диаграмме справа показаны потенциалы синаптического поля гиппокампа. Справа нижний след показывает отрицательную волну, которая соответствует потоку тока, вызванному положительными зарядами, входящими в клетки через постсинаптические глутаматные рецепторы, в то время как верхний след показывает положительную волну, которая генерируется током, покидающим клетку (в теле клетки), чтобы завершить цепь.
Амперометрия
Амперометрия проводится с использованием карбонового электрода для регистрации изменений химического состава окисленных компонентов биологического раствора. Окисление и восстановление осуществляется путем изменения напряжения на активной поверхности регистрирующего электрода в процессе, известном как “сканирование” (scanning). Поскольку определенные химические вещества мозга способны отдавать или принимать электроны при определенных характеристиках напряжения, отдельные виды веществ могут быть идентифицированы. Амперометрия используется для изучения экзоцитоза в нервной и эндокринной системах. Многие моноаминовые нейромедиаторы, например, норадреналин (noradrenalin), допамин и серотонин (5-НТ) окисляются. Этот метод также может быть использован с клетками, которые не выделяют окисляемые нейромедиаторы, “нагружая” их 5-НТ или дофамином.
Планарный patch clamp
Планарный пэтч кламп – это новый метод, разработанный для электрофизиологии, с высокой пропускной способностью.4 Вместо установки пипетки на адгезивную клетку, суспензию клетки пипетируют на микросхему, содержащую микроструктурную щель. Затем одна клетка помещается на отверстие посредством присасывания и образуется плотное соединение (Гигазеал). Плоская геометрия дает целый ряд преимуществ по сравнению с классическим экспериментом:
- Он позволяет интегрировать микрогидродинамику, что способствует автоматическому применению соединения для скрининга ионных каналов;
- Система доступна для оптических или сканирующих зондов;
- Может быть выполнена внутриклеточная перфузия.



Другие методы
Solid-supported membrane (SSM)-based
При таком электрофизиологическом подходе протеолипосомы, мембранные везикулы или фрагменты мембран, содержащие интересующий канал или транспортер, адсорбируются на липидном монослое, окрашенном поверх функционализированного электрода. Этот электрод состоит из стеклянной подложки, слоя хрома, слоя золота и монослоя октадецилмеркаптана. Поскольку окрашенная мембрана поддерживается электродом, она называется твердой мембраной. Важно отметить, что механические возмущения, которые обычно разрушают биологическую липидную мембрану, не влияют на продолжительность жизни ССМ. Емкостный электрод (состоящий из ССМ и поглощенных пузырьков) настолько механически стабилен, что растворы могут заменяться на его поверхности. Это свойство позволяет применять быстрые скачки концентрации субстрата / лиганда для исследования электрогенной активности интересующего белка, измеряемой через емкостную связь между везикулами и электродом.5
Биоэлектрический анализ распознавания (BERA)
Биоэлектрический анализ распознавания (BERA) – это новый метод определения различных химических и биологических молекул путем измерения изменений мембранного потенциала клеток, иммобилизованных в гелевой матрице. Помимо повышенной стабильности поверхности раздела электрод-клетка, иммобилизация сохраняет жизнеспособность и физиологические функции клеток. BERA используется главным образом в биосенсорных приложениях для анализа аналитов, которые могут взаимодействовать с иммобилизованными клетками путем изменения потенциала клеточной мембраны. Таким образом, когда положительный образец добавляется к датчику, происходит характерное, “сигнатурное” изменение электрического потенциала. BERA-это основная технология, лежащая в основе недавно запущенного общеевропейского проекта FOODSCAN, посвященного оценке пестицидных и пищевых рисков в Европе.6 BERA была использована для обнаружения вирусов человека (вирусы гепатита В и С и вирусы герпеса),7 возбудителей ветеринарных заболеваний (вирус ящура, прионый вирус “синего языка”) и вирусов растений (вирусы табака и огурца)8 в специфическом, быстром (1-2 минуты), воспроизводимом и экономичном способе. Метод также использовался для обнаружения токсинов окружающей среды, таких как пестициды91011 и микотоксины12 в пищевых продуктах, а также 2,4,6-трихлоранизол в пробке и вине,1314 а также для определения очень низких концентраций супероксидного аниона в клинических образцах.1516
Датчик BERA состоит из двух частей:
- Расходуемые элементы биорегистрации;
- Электронное считывающее устройство со встроенным искусственным интеллектом 17
Недавним достижением является разработка метода молекулярной идентификации с помощью мембранной инженерии (MIME). Этот метод позволяет создавать клетки с определенной специфичностью практически для любой интересующей молекулы, внедряя тысячи искусственных рецепторов в клеточную мембрану.18
Вычислительная электрофизиология
Хотя это и не является строго экспериментальным измерением, были разработаны методы исследования проводящих свойств белков и биомембран in silico. Это в основном моделирование молекулярной динамики, в котором модельная система, такая как липидный бислой, подвергается внешнему напряжению. Исследования с использованием этих установок позволили изучить такие динамические явления, как электропорация мембран19 и транслокация ионов по каналам.20
Преимуществом таких методов является высокий уровень детализации механизма активной проводимости, обусловленный изначально высоким разрешением и плотностью данных, которые дает атомистическое моделирование. Однако есть существенные недостатки, обусловленные неопределенностью легитимности модели и вычислительной стоимостью моделируемых систем, которые достаточно велики и в достаточных временных масштабах могут рассматриваться как воспроизводящие макроскопические свойства самих систем. В то время как атомистическое моделирование может получить доступ к временным масштабам, близким к микросекундной области, или в микросекундную область, это все еще на несколько порядков ниже, чем даже разрешение экспериментальных методов, таких как patch clamp.
Footnotes
- “The Nobel Prize in Physiology or Medicine 1991”. nobelprize.org. Archived from the original on 10 October 2017. Retrieved 5 May 2018.
- HUBEL DH, WIESEL TN. Receptive fields, binocular interaction and functional architecture in the cat’s visual cortex. J Physiol. 1962 Jan;160(1):106-54. doi: 10.1113/jphysiol.1962.sp006837. PMID: 14449617; PMCID: PMC1359523.
- “The Nobel Prize in Physiology or Medicine 1981”. nobelprize.org. Archived from the original on 23 December 2017. Retrieved 5 May 2018.
- “Archived copy” (PDF). Archived (PDF) from the original on 31 March 2010. Retrieved 17 January 2010.
- Schulz P, Garcia-Celma JJ, Fendler K. SSM-based electrophysiology. Methods. 2008 Oct;46(2):97-103. doi: 10.1016/j.ymeth.2008.07.002.
- Kintzios S, Pistola E, Panagiotopoulos P, Bomsel M, Alexandropoulos N, Bem F, Ekonomou G, Biselis J, Levin R. Bioelectric recognition assay (BERA). Biosens Bioelectron. 2001 Jun;16(4-5):325-36. doi: 10.1016/s0956-5663(01)00127-0.
- Perdikaris A, Alexandropoulos N, Kintzios S. Development of a Novel, Ultra-rapid Biosensor for the Qualitative Detection of Hepatitis B Virus-associated Antigens and Anti-HBV, Based on “Membrane-engineered” Fibroblast Cells with Virus-Specific Antibodies and Antigens. Sensors (Basel). 2009;9(3):2176-86. doi: 10.3390/s90302176. Epub 2009 Mar 25. PMID: 22574007; PMCID: PMC3345828.
- Moschopoulou G, Vitsa K, Bem F, Vassilakos N, Perdikaris A, Blouhos P, Yialouris C, Frosyniotis D, Anthopoulos I, Mangana O, Nomikou K, Rodeva V, Kostova D, Grozeva S, Michaelides A, Simonian A, Kintzios S. Engineering of the membrane of fibroblast cells with virus-specific antibodies: A novel biosensor tool for virus detection. Biosens Bioelectron. 2008 Dec 1;24(4):1033-6. doi: 10.1016/j.bios.2008.06.039.
- Flampouri K, Mavrikou S, Kintzios S, Miliadis G, Aplada-Sarlis P. Development and validation of a cellular biosensor detecting pesticide residues in tomatoes. Talanta. 2010 Mar 15;80(5):1799-804. doi: 10.1016/j.talanta.2009.10.026.
- Mavrikou S, Flampouri K, Moschopoulou G, Mangana O, Michaelides A, Kintzios S. Assessment of Organophosphate and Carbamate Pesticide Residues in Cigarette Tobacco with a Novel Cell Biosensor. Sensors (Basel). 2008 Apr 23;8(4):2818-2832. doi: 10.3390/s8042818. PMID: 27879851; PMCID: PMC3673447.
- Lokka, K. , Skandamis, P. and Kintzios, S. (2013) Screening of Total Organophosphate Pesticides in Agricultural Products with a Cellular Biosensor. CellBio, 2, 131-137. doi: 10.4236/cellbio.2013.23015.
- Evangelia Larou, Iakovos Yiakoumettis, Grigoris Kaltsas, Anastasios Petropoulos, Panagiotis Skandamis, Spiridon Kintzios, High throughput cellular biosensor for the ultra-sensitive, ultra-rapid detection of aflatoxin M1, Food Control,
Volume 29, Issue 1, 2013, Pages 208-212, ISSN 0956-7135, doi: 10.1016/j.foodcont.2012.06.012. - Varelas V, Sanvicens N, M-Pilar-Marco, Kintzios S. Development of a cellular biosensor for the detection of 2,4,6-trichloroanisole (TCA). Talanta. 2011 May 15;84(3):936-40. doi: 10.1016/j.talanta.2011.02.029.
- Apostolou, Theofylaktos & Pascual, Nuria & Marco, M-Pilar & Moschos, Anastassios & Petropoulos, A. & Kaltsas, Grigoris & Kintzios, Spiridon. (2014). Extraction-less, rapid assay for the direct detection of 2,4,6-trichloroanisole (TCA) in cork samples. Talanta. 125. 336–340. doi: 10.1016/j.talanta.2014.03.023.
- Moschopoulou G, Kintzios S. Application of “membrane-engineering” to bioelectric recognition cell sensors for the ultra-sensitive detection of superoxide radical: a novel biosensor principle. Analytica Chimica Acta. 2006 Jul;573-574:90-96. doi: 10.1016/j.aca.2006.01.089.
- Georgia Moschopoulou, Teresa Valero, Spyridon Kintzios, Superoxide determination using membrane-engineered cells: An example of a novel concept for the construction of cell sensors with customized target recognition properties, Sensors and Actuators B: Chemical, Volume 175, 2012, Pages 78-84, ISSN 0925-4005, doi: 10.1016/j.snb.2011.12.056.
- Konstantinos P. Ferentinos, Costas P. Yialouris, Petros Blouchos, Georgia Moschopoulou, Spyridon Kintzios, “Pesticide Residue Screening Using a Novel Artificial Neural Network Combined with a Bioelectric Cellular Biosensor”, BioMed Research International, vol. 2013, Article ID 813519, 8 pages, 2013. doi: 10.1155/2013/813519.
- Kokla A, Blouchos P, Livaniou E, Zikos C, Kakabakos SE, Petrou PS, Kintzios S. Visualization of the membrane engineering concept: evidence for the specific orientation of electroinserted antibodies and selective binding of target analytes. J Mol Recognit. 2013 Dec;26(12):627-32. doi: 10.1002/jmr.2304.
- Gurtovenko AA, Vattulainen I. Ion leakage through transient water pores in protein-free lipid membranes driven by transmembrane ionic charge imbalance. Biophys J. 2007 Mar 15;92(6):1878-90. doi: 10.1529/biophysj.106.094797. Epub 2007 Jan 5. PMID: 17208976; PMCID: PMC1861780.
- Kutzner C, Grubmüller H, de Groot BL, Zachariae U. Computational electrophysiology: the molecular dynamics of ion channel permeation and selectivity in atomistic detail. Biophys J. 2011 Aug 17;101(4):809-17. doi: 10.1016/j.bpj.2011.06.010. PMID: 21843471; PMCID: PMC3175076.