
Нейронные осцилляции или колебания (англ. neural oscillations) — это повторяющиеся ритмически синхронизированные частотные паттерны в центральной нервной системе. Нервная ткань может генерировать осцилляции различными путями за счет внутренних механизмов нейронов или за счет взаимодействий между нейронами. В отдельных нейронах осцилляции проявляются в виде колебаний мембранного потенциала или ритмических потенциалов действия (вспышек), которые в свою очередь передают колебания на постсинаптические нейроны. Синхронизированная активность большого количества нейронов, объединенных в нейронные ансамбли, является главным механизмом образования макроколебаний (мозговых ритмов). Примером макроскопических нейронных колебаний является альфа-активность.
Синхронизированная активность нейронов играет важную роль связи признаков (feature binding), механизмах передачи информации и генерации ритмичного двигательного импульса. Основное направление исследований в области неврологии включает определение того, как генерируются колебания и какова их роль. Многочисленные экспериментальные исследования подтверждают функциональное значение нейронных колебаний; однако единой интерпретации по-прежнему не хватает.
История
В 1875 году Ричард Катон обнародовал результаты своих исследований, в которых обнаружил биоэлектрическую активность в полушариях головного мозга кроликов и обезьян.1 Адольф Бек опубликовал в 1890 году свои наблюдения спонтанной электрической активности мозга кроликов и собак, которая включала ритмические колебания, изменяемые светом, при снятии ЭЭГ непосредственно с коры головного мозга.2 Биоэлектрическая активность головного мозга человека была записана с поверхности кожи головы в 1924 году Гансом Бергером.3 До Ганса Бергера Владимир Владимирович Правдич-Неминским были представлены первое ЭЭГ животного и вызванный потенциал собаки.4
Обзор
Нейронные колебания, порождаемые биоэлектрической активностью головного мозга, наблюдаются во всей центральной нервной системе на всех уровнях ее организации и включают в себя пачки спайков (spike trains/bursting), локальные потенциалы поля (LFP) и крупномасштабные колебания (мозговые волны), которые могут быть измерены с помощью электроэнцефалографии (ЭЭГ). Осцилляции можно охарактеризовать их частотой, амплитудой и фазой. Эти свойства сигнала могут быть извлечены при помощи регистрации электрической активности нейронов мозга с использованием частотно-временного анализа. В крупномасштабных колебаниях изменения амплитуды считаются следствием изменений синхронизации внутри нейронного ансамбля, по-другому это можно назвать локальной синхронизацией. Нейронные осцилляции и синхронизация связаны со многими когнитивными функциями, такими как передача информации, восприятие, контроль движений и память.567
Нейронные колебания были наиболее широко изучены в нейронной активности, генерируемой большими группами нейронов. Крупномасштабная биоэлектрическая активность головного мозга может быть измерена с помощью ЭЭГ. В целом ЭЭГ сигналы имеют широкое спектральное содержание, сходное с розовым шумом, но также можно обнаружить ритмическую активность в определенных частотных диапазонах. Первым обнаруженным и наиболее известным частотным диапазоном является альфа-активность (8-12 Гц)8, которая обнаруживается в затылочной доле во время спокойного бодрствования и усиливается при открывании глаз9 Другие: дельта (1-4 Гц), тета (4-8 Гц), мю (8-13 Гц), бета (13-30 Гц), низкая гамма (30-70 Гц) и высокая гамма (70-150 Гц) частотные диапазоны. Более быстрые ритмы, такие как гамма-активность, связывают с когнитивной функцией. Во время сна наблюдается резкий переход от более быстрых частот к более медленным частотам. Такие переходы ассоциируются с отсутствием сознания, а также часто используются как индикатор наличия сознания у пациента под наркозом.1011
Хотя нейронные осцилляции в деятельности человеческого мозга в основном исследуются с помощью записей ЭЭГ, также их можно изучать с использованием более инвазивных методов, таких как регистрация единичных нейронов. Нейроны могут генерировать ритмические паттерны потенциалов действия или спайков. По деталям механизма генерации и потенциала действия как сами биологические нейроны, так и их модели делят на два больших класса: класс I, или нейроны-интеграторы, и класс II, или нейроны-резонаторы.12 Пачки спайков – это еще одна форма ритмического спайка. Спайкинговые паттерны считаются фундаментальными для кодирования информации в мозге. Ритмическая активность может также наблюдаться в виде подпороговых колебаний мембранного потенциала (т. е. при отсутствии потенциалов действия).13 Количественные модели позволяют оценить силу нейронных колебаний в записанных данных.14
Нейронные колебания обычно изучаются с математической точки зрения и относятся к области “нейродинамики”, это область исследований в когнитивистике, которая уделяет большое внимание динамическому характеру нейронной активности при описании функций мозга.15 Она рассматривает мозг как динамическую систему и использует дифференциальные уравнения для описания того нейронной активности. В частности, она направлена на то, чтобы связать динамические паттерны мозговой деятельности с когнитивными функциями, такими как восприятие и память. В очень абстрактной форме нейронные колебания могут быть проанализированы аналитически. При изучении в более физиологически реалистичной обстановке ритмическая активность обычно изучается с помощью компьютерного моделирования вычислительной модели.
Функции нейронных колебаний являются широкодиапазонными и варьируются для различных типов ритмической активности. Примерами могут служить генерация ритмической активности, такой как сердцебиение, и нейронное связывание (neural binding) сенсорных признаков в перцепции, таких как форма и цвет объекта. Нейронные колебания также играют важную роль во многих неврологических расстройствах, таких как чрезмерная синхронизация во время судорожной активности при эпилепсии или тремор у пациентов с болезнью Паркинсона. Ритмическая активность также может быть использована для управления внешними устройствами в интерфейсах мозг-компьютер, в которых субъекты могут управлять внешним устройством, изменяя амплитуду определенных ритмов мозга.16
Характер активности
Как отдельные нейроны, так и группы нейронов могут спонтанно генерировать колебательную активность. Кроме того, они могут демонстрировать колебательные реакции на перцептивный входой или выходной моторный импульс. Некоторые типы нейронов будут работать ритмично в отсутствие каких-либо синаптических входных импульсов. Аналогичным образом, биоэлектрическая активность мозга в целом порождает ритмическая активность, в то время как нейроны не участвуют в какой-либо деятельности, так называемая активность в состоянии покоя. Эти непрерывные ритмы могут по-разному изменяться в ответ на афферентный или эфферентный импульс. Колебательная активность может реагировать увеличением или уменьшением частоты и амплитуды или показывать временное прерывание, которое называется фазовым сбросом. Кроме того, внешняя активность может вообще не взаимодействовать с ведущей активностью, что приводит к аддитивной реакции.
Фоновая активность
Спонтанная или фоновая активность – это мозговая активность в отсутствие явной задачи, такой как сенсорная или двигательная, и поэтому ее также называют активностью в состоянии покоя. Он противопоставляется активности, связанной с событием (ERP), то есть биоэлектрической дейтельности мозга, которая индуцируется сенсорными стимулами или двигательными реакциями. Термин “ведущая мозговая активность” используется в электроэнцефалографии и магнитоэнцефалографии для обозначения тех компонентов сигнала, которые не связаны с обработкой стимула или возникновением других определенных моментов, таких как перемещение части тела, т. е. события, которые не формируют вызванные потенциалы или индуцированную активность. Спонтанная активность обычно считается шумом, если человек заинтересован в обработке стимулов; однако спонтанная активность играет решающую роль в развитии мозга, например в формировании сетей и синаптогенезе. Спонтанная биоэлектрическая активность может быть информативной относительно текущего психического состояния человека (например, бодрствования, бдительности) и часто используется в исследованиях сна. Некоторые виды мозговых волн, такие как альфа-волны, являются частью спонтанной активности. Статистический анализ флуктуаций мощности альфа-активности выявляет бимодальное распределение, т. е. высоко – и низкоамплитудную виды колебаний, и, следовательно, показывает, что активность в состоянии покоя не просто отражает шумовой процесс.17 В случае фМРТ спонтанные колебания сигнала, зависящего от уровня насыщения кислорода в кровью (BOLD), выявляют корреляционные паттерны, которые связаны с сетями в состоянии покоя, такими как сеть пассивного режима работы мозга.18 Временная эволюция сетей в состоянии покоя коррелирует с флуктуациями колебательной активности ЭЭГ в разных полосах частот.19 Ведущая мозговая активность также может играть важную роль в восприятии, поскольку она способна взаимодействовать с активностью, связанной с входными стимулами. Действительно, исследования ЭЭГ показывают, что зрительное восприятие зависит как от фазы, так и от амплитуды корковых колебаний. Например, амплитуда и фаза альфа-активности в момент визуальной стимуляции предсказывают, будет ли восприниматься субъектом слабый стимул.202122
Частотная характеристика
В ответ на входной сигнал нейрон или нейронный ансамбль может изменять частоту, с которой он колеблется, тем самым изменяя спайковую скорость. Часто скорость срабатывания нейрона зависит от суммарной активности, которую он получает. Изменения частоты также обычно наблюдаются в центральных генераторах паттернов и напрямую связаны со скоростью двигательной активности, такой как частота шагов при ходьбе. Однако изменения относительной частоты колебаний между различными областями мозга не столь распространены, поскольку частота колебательной активности часто связана с временными задержками между этими областями.
Амплитудная характеристика
Наряду с вызванной активностью, нейронная активность, связанная с обработкой стимула, может приводить к индуцированной активности. Индуцированный ответ связан с процессами головного мозга, которые не связаны напрямую со стимулом, а вызваны косвенно нелинейным взаимодействия нейронов после стимула, функционально компонент индуцированного ответа, вероятно, представляет собой процессы обратной кортико-таламической (top-down) связи, связывающие внешние стимулы с внутренней корковой моделью среды, т. е. объединяющую управляемую извне сенсорную информацию с внутренней мозговой активностью. Индуцированный ответ может быть связан с когнитивными функциями мозга, такими как восприятие, внимание и обучение, которые можно рассматривать как процессы более высокого порядка. Хорошо изученным видом индуцированной активности является изменение амплитуды ритмической активности. Например, гамма-активность часто возрастает во время повышенной умственной активности, как во время представления объекта.23 Поскольку индуцированные ответы не связаны с фазой, следовательно, будут исключаться при усреднении, то они могут быть получены только с помощью частотно-временного анализа. Индуцированная активность обычно отражает активность многочисленных нейронов: считается, что амплитудные изменения в колебательной активности возникают в результате синхронизации нейронной активности, например, синхронизации времени спайков или флуктуаций мембранного потенциала отдельных нейронов. Поэтому увеличение ритмической активности часто называю событийной синхронизацией, а уменьшение – событийной десинхронизацией.24
Сброс фазы
Сброс фазы происходит, когда вход в нейрон или нейронный ансамбль сбрасывает фазу текущих колебаний.25Фазовый сброс выполняет три основные функции: 1) выравнивает фазу колебания на определенную точку отсчета для данного события или стимула таким образом, что фазовая информация может быть декодирована последовательно, 2) разрешить периодическому стимулу управлять частотой и фазой нейронного осциллятора, чтобы обеспечить соответствующие временные рамки для кодирования и декодирования, и 3) позволяет взаимно связанным генераторам координировать свои частоты и фазы. Это очень распространено в одиночных нейронах, где время спайка настраивается на нейронный входной импульс (нейрон может спайкнуть с фиксированной задержкой в ответ на периодический входной импульс, что называется фазовой блокировкой), а также может происходить в нейронных ансамблях, когда фазы их нейронов одновременно синхронизируются. Фазовый сброс является фундаментальным для синхронизации различных нейронов или различных областей мозга, поскольку время спайков может стать фазовой блокировкой активности других нейронов. Фазовый сброс также позволяет изучать вызванную активность, термин, используемый в электроэнцефалографии и магнитоэнцефалографии для реакций в мозговой деятельности, которые непосредственно связаны с активностью, связанной со стимулами. Вызванные потенциалы выделяются из электроэнцефалограммы за счет многократной подачи стимулов и суммации каждого последующего ответа с предыдущим, в результате происходит синхронизация накопления ответов, при этом, чем больше число накоплений, тем лучше выделение сигнала из шума. Как следствие, ведущая или спонтанная активность, усредняются. То есть, вызванные потенциалы отражают только те колебания в активности мозга, которые синхронизированы по фазе со стимулом или событием. Вызванная активность часто считается независимой от фоновой мозговой деятельности, хотя этот вопрос остается открытым.2627
Асимметричная амплитудная модуляция
Недавно было высказано предположение, что даже если фазы не совпадают между стимулами, индуцированная активность может по-прежнему вызывать связанные с событиями потенциалы, потому что продолжающиеся колебания мозга могут быть несимметричными, и, таким образом, амплитудные модуляции могут приводить к сдвигу базовой линии, который не усредняется.2829 Эта модель подразумевает, что медленные реакции, связанные с событиями, такие как асимметричная альфа-активность, могут быть результатом асимметричных амплитудных модуляций электрической активности мозга, таких как асимметрия внутриклеточных токов, которые распространяются вперед и назад по дендритам.30 Согласно этому предположению, асимметрия в токе дендритов может вызвать асимметрию ритмической активности, измеряемой ЭЭГ и МЭГ, поскольку считается, что именно эти дендритные токи в пирамидальных клетках генерируют сигналы ЭЭГ и МЭГ.31
Функции
Нейронная синхронизация может модулироваться ограничениями задачи, такими как внимание, и считается, что она играет роль в связи признаков (feature binding), нейрональной коммуникации, и координации движений. Нейронные колебания стали обсуждаемой темой в нейробиологии в 1990-х годах, когда исследования зрительной системы мозга Греем, Сингером и другими учеными, казалось, подтвердили гипотезу о связывании нейронов.32 Согласно этой теории, синхронные колебания в нейронных ансамблях связывают нейроны, представляющие различные особенности объекта. Например, когда человек смотрит на дерево, нейроны зрительной коры, представляющие ствол дерева, и те, которые представляют ветви одного и того же дерева, будут синхронно колебаться, образуя единое представление дерева. Этот феномен лучше всего виден в локальных потенциалах поля, которые отражают синхронную активность локальных групп нейронов, но также это было показано в записях ЭЭГ и МЭГ, которые предоставляют все больше свидетельств о тесной связи между синхронной ритмической активностью и различными когнитивными функциями, такими как перцептивные группировки.33
Пейсмейкер
Клетки синоатриального узла (СА), расположенного в правом предсердии сердца латеральнее места впадения верхней полой вены, способны спонтанно деполяризоваться около 100 раз в минуту. Хотя все клетки сердца обладают способностью генерировать потенциалы действия, которые вызывают сердечное сокращение, синоатриальный узел является вводителем ритма, вследствие того, что генерирует импульс быстрее других отделов проводящей системы сердца. Следовательно, эти клетки генерируют нормальный синусовый ритм и называются пейсмейкерными клетками, поскольку они напрямую контролируют частоту сердечных сокращений. При отсутствии внешнего нейронного и гормонального контроля клетки в СА узле будут ритмично разряжаться. Синоатриальный узел богато иннервируется вегетативной нервной системой, которая регулирует частоту самопроизвольных срабатываний пейсмейкерных клеток.
Центральный генератор паттернов
Синхронное возбуждение нейронов также составляет основу периодических двигательных команд для ритмических движений. Эти ритмические выходные импульсы производятся группой взаимодействующих нейронов, которые образуют сеть, называемую центральным генератором паттернов. Центральные генераторы паттернов – это нейронные цепи, при активации которых формируются ритмические двигательные паттерны в отсутствие сенсорных или моторных импульсов, несущих специфическую информацию о синхронизации, к примеру ходьба, дыхание и плавание.34 Сведения о наличии центральных генераторов паттернов были получены от низших животных, таких как минога, но есть также доказательства наличия центральных генераторов спинальных структур и у людей.3536
Обработка информации
Нейрональные спайки обычно считаются основой для передачи информации в головном мозге. Для такой передачи, информация должна быть закодирована в виде спайкового паттерна. Были предложены различные типы схем кодирования, такие как кодирование скорости и темпоральное кодирование. Нейронные колебания могут создавать периодические временные окна, в которых входные спайки оказывают большее влияние на нейроны, обеспечивая тем самым механизм декодирования временных кодов.37
Перцепция
Синхронизация возбуждения нейронов может служить средством группировки пространственно сегрегированных нейронов, реагирующих на один и тот же стимул, чтобы связать эти реакции для дальнейшей совместной обработки, т. е. использовать временную синхронизацию для кодирования этих взаимодействий. Сначала были предложены чисто теоретические формулировки гипотезы связывания с помощью синхронности38, но впоследствии были получены обширные экспериментальные данные, подтверждающие потенциальную роль синхронности как реляционного кода.39 Функциональная роль синхронизированной колебательной активности в головном мозге была в основном установлена в экспериментах, проведенных на бодрствующих котятах с электродами, имплантированными в зрительную кору. Эти эксперименты показали, что группы пространственно сегрегированных нейронов участвуют в синхронной ритмической активности при активации зрительными стимулами. Частота этих колебаний находилась в диапазоне 40 Гц и отличалась от периодической активации, индуцированной решеткой (светлые и тёмные полосы определённой ширины), что позволяет предположить, что колебания и их синхронизация были обусловлены внутренними нейрональными взаимодействиями. Найдены клетки с чувствительностью к разным пространственным частотам. Считается, что это свойство обеспечивает зрительной системе способность выделять из изображения участки с разной текстурой. Из этого можно вывести, что колебания и их синхронизация были обусловлены внутренними нейрональными взаимодействиями. Аналогичные результаты были продемонстрированы параллельно группой Экхорна, предоставив дополнительные доказательства функциональной роли нейронной синхронизации в связывании признаков.40 C тех пор многочисленные исследования повторили эти результаты и распространили их на различные методы, такие как ЭЭГ, предоставляя обширные доказательства функциональной роли гамма-колебаний в зрительном восприятии. Жиль Лоран и его коллеги показали, что колебательная синхронизация играет важную функциональную роль в восприятии запаха. Восприятие различных запахов приводит к тому, что различные подмножества нейронов запускают различные наборы колебательных циклов.41 Эти колебания могут быть нарушены ГАМК-блокатором пикротоксином42, а нарушение колебательной синхронизации приводит к нарушению поведенческой дискриминации химически сходных одорантов у пчел43 и к более сходным реакциям на запахи в нижележащих β-долевых нейронах.44 Недавнее продолжение этого исследования показало, что колебания создают периодические окна интеграции для клеток Кеньона в грибовидном теле насекомых, таким образом, входящие спайки из обонятельной доли более эффективны в активации клеток Кеньона только на определенных фазах колебательного цикла. Также считается, что нейронные колебания участвуют в чувстве времени45 и в соматосенсорном восприятии.46 Недавние результаты исследований доказывают, что функция корковых гамма-колебаний подобна часам.47
Координация движений
Колебания обычно сообщаются в двигательной системе. Pfurtscheller и его коллеги обнаружили снижение альфа (8–12 Гц) и бета (13–30 Гц) колебаний в активности ЭЭГ, когда испытумые совершали движение.48 Используя внутрикортикальные записи, аналогичные изменения в колебательной активности были обнаружены в моторной коре, когда обезьяны выполняли движения, требующие значительного сосредоточения.4950 Кроме того, колебания на спинномозговом уровне синхронизируются с бета-колебаниями в моторной коре во время постоянной активации мышц, что определяется кортико-мышечной когерентностью.515253 Аналогичным образом, мышечная активность различных мышц выявляет межмышечную когерентность на нескольких различных частотах, отражая основные нервные цепи, участвующие в координации движений.5455 Недавно было обнаружено, что кортикальные колебания распространяются в виде бегущих волн по поверхности моторной коры вдоль доминирующих пространственных осей, характерных для локальной схемы двигательной коры.56 Было высказано предположение, что двигательные команды в виде бегущих волн могут быть пространственно отфильтрованы нисходящими волокнами для избирательного управления мышечной силой.57 Моделирование показало, что продолжающаяся волновая активность в коре головного мозга может вызывать устойчивую мышечную силу с физиологическими уровнями когерентности ЭЭГ-ЭМГ.58 Колебательные ритмы с частотой 10 Гц были зафиксированы в области мозга, называемой нижней оливой, которая связана с мозжечком. Эти колебания также наблюдаются при моторном импульсе физиологического тремора59 и при выполнении медленных движений пальцев.60 Эти данные могут свидетельствовать о том, что человеческий мозг периодически контролирует непрерывные движения. В подтверждение этого было показано, что данная прерывистость движений непосредственно коррелируют с ритмической активностью в мозжечково-таламо-кортикальной петле, которая может представлять собой нейронный механизм для прерывистого двигательного контроля.61
Память
Нейронные колебания, в частности тета-активность, тесно связаны с функцией памяти. Тета-ритмы очень активны в гиппокампе и энторинальной коре грызунов во время обучения и восстановления памяти, и они, как полагают, жизненно важны для индукции долговременной потенциации, возможного клеточного механизма обучения и памяти. Считается, что связь между тета-и гамма-активностью жизненно важна для функций памяти, включая эпизодическую память.6263 Тесная координация спайков одиночных нейронов с локальными тета-колебаниями связана с успешным формированием памяти у людей, поскольку более стереотипные спайки прогнозируют лучшую память.64 (as more stereotyped spiking predicts better memory)
Сон и сознание
➥ Основная статья: Сон: ЭЭГ диагностика нарушений сна
Сон – это естественно повторяющееся состояние, характеризующееся сниженным или отсутствующим сознанием, состоящий из быстрой (REM) и медленной (NREM) фаз. Стадии сна характеризуются спектральным содержанием ЭЭГ: например, стадия N1 относится к переходу мозга от альфа-волн (спокойное бодрствование) к тета-волнам, тогда как стадия N3 (глубокий или медленный сон) характеризуется наличием дельта-волн. Нормальный порядок стадий сна – N1 → N2 → N3 → N2 → REM.
Развитие
Нервные колебания могут играть определенную роль в развитии нервной системы. Например, считается, что волны сетчатки глаза обладают свойствами, которые определяют раннее соединение сетей и синапсов между клетками сетчатки.65
Патология
Специфические типы нервных колебаний могут также проявляться в патологических ситуациях, таких как болезнь Паркинсона или эпилепсия. Эти патологические колебания часто состоят из аберрантного варианта нормального колебания. Например, один из наиболее известных типов – это спайковые и волновые колебания, которые характерны для генерализованных или отсутствующих эпилептических припадков и которые напоминают нормальные осцилляции веретена сна. Изменения ЭЭГ при патологическом процессе могут быть диффузными и локальными. Диффузные поражения мозга чаще всего регистрируются при менингитах, токсических поражениях, энцефалопатиях различного генеза и заключаются в отсутствии регулярной доминирующей активности, нарушении нормального топического распределения альфа- и бета-ритма, появлении диффузных патологических колебаний в виде высокоамплитудных тета-, дельта-волн. Локальные изменения на ЭЭГ возникают при очаговых поражениях головного мозга.
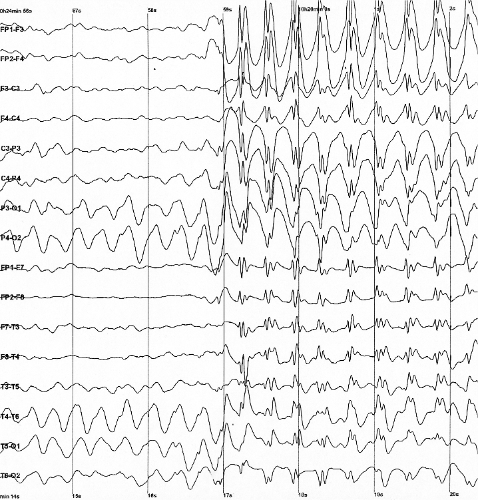
Тремор
Тремор – это непроизвольное, несколько ритмичное мышечное сокращение и расслабление, вовлекающее одну или несколько частей тела. Это наиболее распространенное из всех непроизвольных движений, которое может поражать руки, кисти, глаза, лицо, голову, голосовые связки, туловище и ноги. Чаще всего дрожь возникает в руках. У некоторых людей тремор является симптомом другого неврологического расстройства. Было выявлено много различных форм тремора, таких как эссенциальный тремор или паркинсонический тремор. Утверждается, что треморы, по-видимому, имеют многофакторное происхождение с участием нервных колебаний в центральной нервной системе, а также периферических механизмов, такие как резонансы рефлекторной петли.66
Эпилепсия
➥ Более подробно: Эпилептическая активность
Эпилепсия является распространенным хроническим неврологическим расстройством, характеризующимся судорогами. Эти припадки являются временными признаками и/или симптомами ненормальной, чрезмерной или гиперсинхронной активности нейронов в головном мозге. В зависимости от типа эпилепсии, могут быть применены различные подходы к моделированию динамических процессов, приводящих к массовой синхронизации нейронов.67
Таламокортикальная дисритмия
При таламокортикальной дисритмии (ТКД) нарушается нормальный таламокортикальный резонанс. Таламическая потеря входного сигнала позволяет частоте таламокортикального столба замедляться в тета- или дельта-диапазоне, определяемом МЭГ и ЭЭГ с помощью машинного обучения.68 ТКД можно лечить с помощью нейрохирургических методов, таких как таламотомия.
Области применения
Клинические результаты
Нейронные колебания чувствительны к нескольким препаратам, влияющим на биоэлектрическую мозговую активность; соответственно, биомаркеры, основанные на нейронных колебаниях, появляются в качестве второстепенных критериев оценки в клинических испытаниях и при количественной оценке эффектов в доклинических исследованиях. Эти биомаркеры часто называют “биомаркерами ЭЭГ” или “нейрофизиологическими биомаркерами” и количественно оценивают с помощью количественной электроэнцефалографии (qEEG). Биомаркеры ЭЭГ могут быть извлечены из ЭЭГ с использованием Neurophysiological Biomarker Toolbox с открытым исходным кодом.
Интерфейс мозг-компьютер
➥ Более подробно: Нейрокомпьютерный интерфейс
Нейронные колебания применялись в качестве управляющего сигнала в различных интерфейсах мозг-компьютер (BCI).69 Например, неинвазивный BCI можно создать, поместив электроды на кожу головы и затем измеряя слабые электрические сигналы. Хотя отдельные нейронные активности не могут быть восстановлены с помощью неинвазивного BCI, поскольку череп демпфирует и размывает электромагнитные сигналы, ритмическая активность все еще может быть надежно обнаружена. Проблема использования ЭЭГ для создания нейро-компьютерного интерфейса, который бы позволил управлять физическими объектами была впервые поставлена Видалем в 1973 году.70 Успешное решение было представлено в 1988 году, когда с помощью альфа-ритма ЭЭГ удалось осуществить контроль передвижения мобильного робота.7172 BCI на основе альфа-ритма стал первым BCI для управления роботом.7374 В частности, некоторые формы BCI позволяют пользователям управлять устройством, путем измерения амплитуды колебательной активности в определенных частотных диапазонах, включая мю и бета-ритмы.
Читайте также
- Пачка спайков / вспышка (Bursting)
- Нейронная активность
- Модель одиночного диполя
- Активность одиночного нейрона
- Активность нейронной популяции
- Локальные потенциалы
- Потенциал действия нейрона
- Вызванные потенциалы
Footnotes
- “Caton, Richard – The electric currents of the brain”. echo.mpiwg-berlin.mpg.de. Retrieved 2018-12-21.
- Coenen, Anton; Edward Fine; Oksana Zayachkivska (2014). “Adolf Beck: A Forgotten Pioneer In Electroencephalography”. Journal of the History of the Neurosciences. 23 (3): 276–286. doi:10.1080/0964704x.2013.867600.
- Llinas, R. R. (2014). “Intrinsic electrical properties of mammalian neurons and CNS function: a historical perspective”. Front Cell Neurosci. 8: 320. doi:10.3389/fncel.2014.00320.
- Pravdich-Neminsky, VV. (1913). “Ein Versuch der Registrierung der elektrischen Gehirnerscheinungen”. Zentralblatt für Physiologie. 27: 951–60.
- Fries P (2005). “A mechanism for cognitive dynamics: neuronal communication through neuronal coherence”. Trends in Cognitive Sciences. 9 (10): 474–480. doi:10.1016/j.tics.2005.08.011.
- Fell J, Axmacher N (2011). “The role of phase synchronization in memory processes”. Nature Reviews Neuroscience. 12 (2): 105–118. doi:10.1038/nrn2979.
- Schnitzler A, Gross J (2005). “Normal and pathological oscillatory communication in the brain”. Nature Reviews Neuroscience. 6 (4): 285–296. doi:10.1038/nrn1650.
- Foster, JJ; et al. (July 2017). “Alpha-Band Oscillations Enable Spatially and Temporally Resolved Tracking of Covert Spatial Attention”. Psychological Science. 28 (7): 929–941. doi:10.1177/0956797617699167.
- Berger H, Gray CM (1929). “Uber das Elektroenkephalogramm des Menschen”. Arch Psychiat Nervenkr. 87: 527–570. doi:10.1007/BF01797193.
- Engel AK, Singer W (2001). “Temporal binding and the neural correlates of sensory awareness”. Trends in Cognitive Sciences. 5(1): 16–25. doi:10.1016/S1364-6613(00)01568-0.
- Varela F, Lachaux JP, Rodriguez E, Martinerie J (2001). “The brainweb: phase synchronization and large-scale integration”. Nature Reviews Neuroscience. 2 (4): 229–239. doi:10.1038/35067550.
- Izhikevich EM (2007). Dynamical systems in neuroscience. Cambridge, Massachusetts: The MIT Press.
- Llinas R, Yarom Y (1986). “Oscillatory properties of guinea-pig inferior olivary neurones and their pharmacological modulation: an in vitro study”. J Physiol. 376: 163–182. doi:10.1113/jphysiol.1986.sp016147.
- Mureșan RC, Jurjuț OF, Moca VV, Singer W, Nikolić D (2008). “The Oscillation Score: An Efficient Method for Estimating Oscillation Strength in Neuronal Activity”. Journal of Neurophysiology. 99 (3): 1333–1353. doi:10.1152/jn.00772.2007.
- Burrow T (1943). “The neurodynamics of behavior. A phylobiological foreword”. Philosophy of Science. 10 (4): 271–288. doi:10.1086/286819.
- Vansteensel, Mariska J.; Pels, Elmar G.M.; Bleichner, Martin G.; Branco, Mariana P.; Denison, Timothy; Freudenburg, Zachary V.; Gosselaar, Peter; Leinders, Sacha; Ottens, Thomas H.; Van Den Boom, Max A.; Van Rijen, Peter C.; Aarnoutse, Erik J.; Ramsey, Nick F. (2016). “Fully Implanted Brain–Computer Interface in a Locked-In Patient with ALS”. New England Journal of Medicine. 375 (21): 2060–2066. doi:10.1056/NEJMoa1608085. hdl:1874/344360.
- Freyer F, Aquino K, Robinson PA, Ritter P, Breakspear M (2009). “Bistability and non-Gaussian fluctuations in spontaneous cortical activity”. J Neurosci. 29 (26): 8512–8524. doi:10.1523/JNEUROSCI.0754-09.2009.
- Fox MD, Raichle ME (2007). “Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging”. Nat Rev Neurosci. 8 (9): 700–711. doi:10.1038/nrn2201.
- Laufs H, Kraków K, Sterzer P, Eger E, Beyerle A, Salek-Haddadi A, Kleinschmidt A (2003). “Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging”. PNAS. 100 (19): 11053–11058. Bibcode:2003PNAS..10011053L. doi:10.1073/pnas.1831638100.
- Mathewson KE, Gratton G, Fabiani M, Beck DM, Ro T (2009). “To see or not to see: Prestimulus α phase predicts visual awareness”. J Neurosci. 29 (9): 2725–32. doi:10.1523/JNEUROSCI.3963-08.2009.
- Busch NA, Dubois J, VanRullen R (2009). “The phase of ongoing EEG oscillations predicts visual perception”. J Neurosci. 29 (24): 7869–76. doi:10.1523/jneurosci.0113-09.2009.
- van Dijk H, Schoffelen JM, Oostenveld R, Jensen O (2008). “Prestimulus oscillatory activity in the alpha band predicts visual discrimination ability”. J Neurosci. 28 (8): 1816–1823. doi:10.1523/jneurosci.1853-07.2008.
- Tallon-Baudry C, Bertrand O (1999). “Oscillatory gamma activity in humans and its role in object representation”. Trends Cogn Sci. 3 (4): 151–162. doi:10.1016/S1364-6613(99)01299-1.
- Pfurtscheller G; da Silva FHL (1999). “Event-related EEG/MEG synchronization and desynchronization: basic principles”. Clin Neurophysiol. 110 (11): 1842–1857. doi:10.1016/S1388-2457(99)00141-8.
- Tass PA (2007). Phase resetting in medicine and biology: stochastic modelling and data analysis. Berlin Heidelberg: Springer-Verlag.
- Makeig S, Westerfield M, Jung TP, Enghoff S, Townsend J, Courchesne E, Sejnowski TJ (2002). “Dynamic brain sources of visual evoked responses”. Science. 295 (5555): 690–694. Bibcode:2002Sci…295..690M. doi:10.1126/science.1066168.
- Mäkinen V, Tiitinen H, May P (2005). “Auditory event-related responses are generated independently of ongoing brain activity”. NeuroImage. 24 (4): 961–968. doi:10.1016/j.neuroimage.2004.10.020.
- Nikulin VV, Linkenkaer-Hansen K, Nolte G, Lemm S, Muller KR, Ilmoniemi RJ, Curio G (2007). “A novel mechanism for evoked responses in the human brain”. Eur J Neurosci. 25 (10): 3146–3154. doi:10.1111/j.1460-9568.2007.05553.x.
- Mazaheri A, Jensen O (2008). “Asymmetric amplitude modulations of brain oscillations generate slow evoked responses”. J Neurosci. 28 (31): 7781–7787. doi:10.1523/JNEUROSCI.1631-08.2008.
- Mazaheri A, Jensen O (2008). “Rhythmic pulsing: linking ongoing brain activity with evoked responses”. Front Hum Neurosci. 4: 117. doi:10.3389/fnhum.2010.00177.
- Hamalainen M, Hari R, Ilmoniemi RJ, Knuutila J, Lounasmaa OV (1993). “Magnetoencephalography – Theory, instrumentation, and applications to noninvasive studies of the working human brain”. Rev Mod Phys. 65 (2): 413–497. Bibcode:1993RvMP…65..413H. doi:10.1103/RevModPhys.65.413.
- Singer W, Gray CM (1995). “Visual feature integration and the temporal correlation hypothesis”. Annu Rev Neurosci. 18: 555–586. CiteSeerX 10.1.1.308.6735. doi:10.1146/annurev.ne.18.030195.003011.
- Singer W (1993). “Synchronization of cortical activity and its putative role in information processing and learning”. Annu Rev Physiol. 55: 349–374. doi:10.1146/annurev.ph.55.030193.002025.
- Marder E, Bucher D (2001). “Central pattern generators and the control of rhythmic movements”. Curr Biol. 11 (23): R986–R996. doi:10.1016/S0960-9822(01)00581-4.
- Dimitrijevic MR, Gerasimenko Y, Pinter MM (1998). “Evidence for a spinal central pattern generator in humans”. Annals of the New York Academy of Sciences. 860 (1): 360–376. Bibcode:1998NYASA.860..360D. doi:10.1111/j.1749-6632.1998.tb09062.x.
- Danner SM, Hofstoetter US, Freundl B, Binder H, Mayr W, Rattay F, Minassian K (March 2015). “Human spinal locomotor control is based on flexibly organized burst generators”. Brain. 138 (Pt 3): 577–88. doi:10.1093/brain/awu372.
- Gupta N, Singh SS, Stopfer M (December 2016). “Oscillatory integration windows in neurons”. Nature Communications. 7: 13808. Bibcode:2016NatCo…713808G. doi:10.1038/ncomms13808.
- Milner PM (1974). “A model for visual shape recognition”. Psychol. Rev. 81 (6): 521–535. doi:10.1037/h0037149. PMID 4445414.
- Gray CM, König P, Engel AK, Singer W (1989). “Oscillatory responses in cat visual cortex exhibit inter-columnar synchronization which reflects global stimulus properties”. Nature. 338 (6213): 334–337. Bibcode:1989Natur.338..334G. doi:10.1038/338334a0.
- Eckhorn R, Bauer R, Jordan W, Brosch M, Kruse W, Munk M, Reitboeck HJ (1988). “Coherent oscillations: A mechanism of feature linking in the visual cortex? Multiple electrode and correlation analyses in the cat”. Biol Cybern. 60 (2): 121–130. doi:10.1007/BF00202899.
- Wehr M, Laurent G (1996). “Odour encoding by temporal sequences of firing in oscillating neural assemblies”. Nature. 384(6605): 162–166. Bibcode:1996Natur.384..162W. doi:10.1038/384162a0.
- MacLeod K, Laurent G (1996). “Distinct mechanisms for synchronization and temporal patterning of odor-encoding neural assemblies”. Science. 274 (5289): 976–979. Bibcode:1996Sci…274..976M. doi:10.1126/science.274.5289.976.
- Stopfer M, Bhagavan S, Smith BH, Laurent G (1997). “Impaired odour discrimination on desynchronization of odour-encoding neural assemblies”. Nature. 390 (6655): 70–74. Bibcode:1997Natur.390…70S. doi:10.1038/36335.
- MacLeod K, Bäcker A, Laurent G (1998). “Who reads temporal information contained across synchronized and oscillatory spike trains?”. Nature. 395 (6703): 693–698. Bibcode:1998Natur.395..693M. doi:10.1038/27201.
- Buhusi CV, Meck WH (2005). “What makes us tick? Functional and neural mechanisms of interval timing”. Nature Reviews Neuroscience. 6 (10): 755–65. doi:10.1038/nrn1764. PMID 16163383.
- Ahissar E, Zacksenhouse M (2001). Temporal and spatial coding in the rat vibrissal system. Prog Brain Res. Progress in Brain Research. 130. pp. 75–87. doi:10.1016/S0079-6123(01)30007-9.
- Burns SP, Xing D, Shapley RM (2011). “Is gamma-band activity in the local field potential of V1 cortex a “clock” or filtered noise?”. J Neurosci. 31 (26): 9658–9664. doi:10.1523/jneurosci.0660-11.2011.
- Pfurtscheller G, Aranibar A (1977). “Event-related cortical desynchronization detected by power measurements of scalp EEG”. Electroencephalogr Clin Neurophysiol. 42 (6): 817–826. doi:10.1016/0013-4694(77)90235-8.
- Murthy VN, Fetz EE (1996). “Oscillatory activity in sensorimotor cortex of awake monkeys: Synchronization of local field potentials and relation to behavior”. J Neurophysiol. 76 (6): 3949–3967. doi:10.1152/jn.1996.76.6.3949.
- Sanes JN, Donoghue JP (1993). “Oscillations in local-field potentials of the primate motor cortex during voluntary movement”. PNAS. 90 (10): 4470–4474. Bibcode:1993PNAS…90.4470S. doi:10.1073/pnas.90.10.4470.
- Conway, BA; Halliday, DM; Farmer, SF (1995). “Synchronization between motor cortex and spinal motoneuronal pool during the performance of a maintained motor task in man”. J Physiol. 489(3): 917–924. doi:10.1113/jphysiol.1995.sp021104.
- Salenius S, Portin K, Kajola M, et al. (1997). “Cortical control of human motoneuron firing during isometric contraction”. J Neurophysiol. 77 (6): 3401–3405. doi:10.1152/jn.1997.77.6.3401. PMID 9212286.
- aker SN, Olivier E, Lemon RN (1997). “Coherent oscillations in monkey motor cortex and hand muscle EMG show task-dependent modulation”. J Physiol. 501 (1): 225–241. doi:10.1111/j.1469-7793.1997.225bo.x.
- Boonstra TW, Danna-Dos-Santos A, Xie HB, Roerdink M, Stins JF, Breakspear M (2015). “Muscle networks: Connectivity analysis of EMG activity during postural control”. Sci Rep. 5: 17830. Bibcode:2015NatSR…517830B. doi:10.1038/srep17830.
- Kerkman JN, Daffertshofer A, Gollo LL, Breakspear M, Boonstra TW (June 2018). “Network structure of the human musculoskeletal system shapes neural interactions on multiple time scales”. Science Advances. 4 (6): eaat0497. Bibcode:2018SciA….4..497K. doi:10.1126/sciadv.aat0497.
- Rubino, D; Robbins, KA; Hatsopoulos, NG (2006). “Propagating waves mediate information transfer in the motor cortex”. Nat Neurosci. 9 (12): 1549–1557. doi:10.1038/nn1802.
- Heitmann S, Boonstra T, Gong P, Breakspear M, Ermentrout B (2015). “The rhythms of steady posture: Motor commands as spatially organized oscillation patterns”. Neurocomputing. 170: 3–14. doi:10.1016/j.neucom.2015.01.088.
- Heitmann S, Boonstra T, Breakspear M (2013). “A dendritic mechanism for decoding traveling waves: Principles and applications to motor cortex”. PLOS Computational Biology. 9(10): e1003260. Bibcode:2013PLSCB…9E3260H. doi:10.1371/journal.pcbi.1003260.
- Allum JH, Dietz V, Freund HJ (1978). “Neuronal mechanisms underlying physiological tremor”. J Neurophysiol. 41 (3): 557–571. doi:10.1152/jn.1978.41.3.557.
- Vallbo AB, Wessberg J (1993). “Organization of motor output of slow finger movements in man”. J Physiol. 469: 673–691. doi:10.1113/jphysiol.1993.sp019837.
- Gross J, Timmermann J, Kujala J, Dirks M, Schmitz F, Salmelin R, Schnitzler A (2002). “The neural basis of intermittent motor control in humans”. PNAS. 99 (4): 2299–2302. Bibcode:2002PNAS…99.2299G. doi:10.1073/pnas.032682099.
- Buszaki G (2006). Rhythms of the brain. Oxford University Press.
- Nyhus E, Curran T (June 2010). “Functional role of gamma and theta oscillations in episodic memory”. Neuroscience and Biobehavioral Reviews. 34 (7): 1023–35. doi:10.1016/j.neubiorev.2009.12.014.
- Rutishauser U, Ross IB, Mamelak AN, Schuman EM (April 2010). “Human memory strength is predicted by theta-frequency phase-locking of single neurons” (PDF). Nature. 464 (7290): 903–7. Bibcode:2010Natur.464..903R. doi:10.1038/nature08860.
- Feller, Marla B (2009-07-06). “Retinal waves are likely to instruct the formation of eye-specific retinogeniculate projections”. Neural Development. 4: 24. doi:10.1186/1749-8104-4-24. ISSN 1749-8104.
- McAuley JH, Marsden CD (2000). “Physiological and pathological tremors and rhythmic central motor control”. Brain. 123 (8): 1545–1567. doi:10.1093/brain/123.8.1545.
- V. Shusterman and W. C. Troy. From baseline to epileptiform activity: A path to synchronized rhythmicity in large-scale neural networks. Phys Rev E Stat Nonlin Soft Matter Phys. 2008;77(6 Pt 1):061911
- Vanneste S, Song JJ, De Ridder D (March 2018). “Thalamocortical dysrhythmia detected by machine learning”. Nature Communications. 9 (1): 1103. Bibcode:2018NatCo…9.1103V. doi:10.1038/s41467-018-02820-0.
- Birbaumer, Neils (2006). “Breaking the silence: Brain-computer interfaces (BCI) for communication and motor control”. Psychophysiology. 43 (6): 517–32. doi:10.1111/j.1469-8986.2006.00456.x.
- J. Vidal: Toward direct brain-computer communication. Annual Review of Biophysics and Bioengineering. 2(1): 157–80, 1973
- S. Bozinovski, M. Sestakov, L. Bozinovska: Using EEG alpha rhythm to control a mobile robot, In G. Harris, C. Walker (eds.) Proc. IEEE Annual Conference of Medical and Biological Society, p. 1515-1516, New Orleans, 1988
- S. Bozinovski: Mobile robot trajectory control: From fixed rails to direct bioelectric control, In O. Kaynak (ed.) Proc. IEEE Workshop on Intelligent Motion Control, p. 63-67, Istanbul, 1990
- M. Lebedev: Augmentation of sensorimotor functions with neural prostheses. Opera Medica and Physiologica. Vol. 2 (3): 211-227, 2016
- M. Lebedev, M. Nicolelis: Brain-machine interfaces: from basic science to neuroprostheses and neurorehabilitation, Physiological Review 97:737-867, 2017