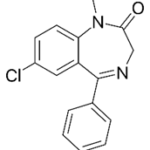
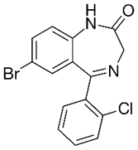
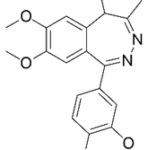
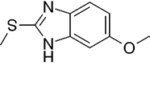
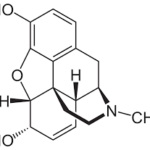
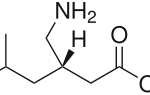
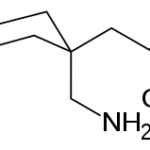
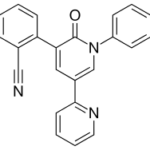
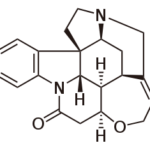
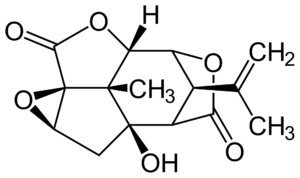
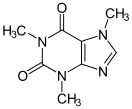
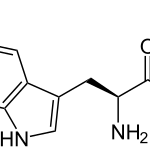
Прогноз фармакологических свойств
Поиск фундаментальных закономерностей
Серия научных публикаций
1
Интракраниальный массив электродов, адаптер и регистрирующая головка
2
Система предъявления стимулов для оценки реактивных изменений ЭЭГ
3
Цифровая лабораторная система регистрации данных
4
Компьютер
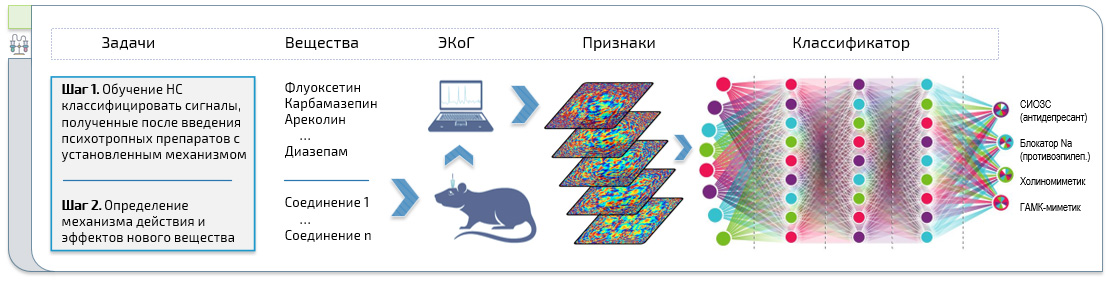
Настоящая фундаментальная работа посвящена разработке нового метода определения механизма действия психотропных веществ и оценке их влияния на нейрональную активность. Использован трансдисциплинарный подход, объединяющий в себе нейрофармакологию, электрофизиологию, прикладную математику и программирование.
Исследование базируется на гипотезе о наличии специфических электроэнцефалографических паттернов, характерных для действия различных нейропсихотропных средств, что в достаточной мере подтверждается накопленным опытом фармако-ЭЭГ исследований. Фармакодинамика закономерно отражается в биоэлектрической активности мозга, следовательно, анализ ЭКоГ позволяет извлечь информацию о механизме действия вещества.
На первом этапе были впервые успешно использованы алгоритмы машинного обучения для классификации эффектов психотропных средств. Усовершенствованы методы сбора и анализа данных.
Конечной целью является идентификация механизма действия новых соединений и спектра их эффектов (с количественной оценкой), а также репозиционирование препаратов на основании анализа ЭКоГ с помощью искусственных нейронных сетей.
Общий прогресс
Регистрация данных
Дата завершения: 20 сентября 2022 г.
Анализ данных
Дата завершения: 10 ноября 2022 г.
Введение
Обзор литературы выполнен в рамках задачи поиска научной основы для создания полномерной системы взаимосвязей между гетерогенными фармакологическими группами психотропных средств. Накоплен корпус научных документов по основным нейропсихотропным эффектам (которые представлены родительскими узлами, интерактивная фигура 1), связанным с наиболее часто исследуемыми в электрофизиологических моделях препаратами (представлены дочерними узлами).
Актуальность. В государственной программе правительства Российской Федерации “Развитие фармацевтической и медицинской промышленности” (ред. от 29 марта 2019 г.) на главную позицию выдвинута подпрограмма 1 “Развитие производства лекарственных средств”, в которой первоочередной задачей является разработка лекарственных средств для лечения социально значимых заболеваний. Подавляющая часть психоневрологических заболеваний относится к категории социально значимых. Таким образом, разработка новых нейропсихотропных средств является приоритетным направлением развития науки.
Механизм действия не менее чем 20% нейропсихотропных препаратов, применяемых в клинической практике, остается недостаточно изученным [1]. Необходимо подчеркнуть, что проблема понимания молекулярных механизмов в отношении психотропных средств стоит значительно острее, чем в отношении других лекарственных групп. Это существенно осложняет оценку их фармакологических свойств, затрудняет прогноз лекарственных взаимодействий и препятствует разработке новых препаратов. В основе лекарственной безопасности так же лежит понимание фармакодинамики [2]. Актуальность проблемы изучения молекулярного механизма действия психотропных средств продиктована не только высокой социально-экономической значимостью, но и главными эпистемологическими целями нейрофармакологии как научной дисциплины.
Наряду с этим, классические методы фармакологии, направленные на изучение механизма действия, отличаются в большинстве случаев низкой пропускной способностью, высокой трудоемкостью и значительными экономическими затратами. На данный момент отсутствуют универсальные методы оценки фармакологических свойств, которые могли бы на начальных этапах доклинического исследования задать вектор дальнейшего научного поиска.
Тем не менее, благодаря прогрессу в области развития алгоритмов машинного обучения удалось существенно расширить сферу их применения за последнее время. Инновационные методы глубокого обучения начинают активно и плодотворно использоваться в направлении анализа биомедицинских сигналов. Учитывая это, есть основания считать высокоперспективным применение методов машинного обучения для анализа электрофизиологических сигналов с целью извлечения информации о действии веществ.
Проблема: При исследовании механизма действия традиционно используется три подхода DTIP (drug target interaction prediction): на основе структуры лиганда (ligand-based), на основе структуры мишени (докинг) и хемогеномный метод, объединяющий химическое пространство лиганда и мишени через геном.
Классические подходы DTIP малоэффективны при рассеянном склерозе, болезни Паркинсона, Альцгеймера, психиатрических заболеваниях, поскольку: а) синтезировано недостаточно лигандов или вообще не синтезировано; б) не выявлены адекватные мишени.
Решение: Предложен оригинальный метод биопотенциал-опосредованного DTIP, реализованный при помощи конволюционных нейронных сетей с модифицированным алгоритмом избирательной редукции параметров, который ассоциирует соединение и мишень, либо соединение и эффект через промежуточное звено в виде биоэлектрического отклика на введение вещества.
Преимущество подхода заключается в том, что нервная ткань является идеальным детектором психотропного вещества, поскольку психотропные эффекты полномерно и специфическим образом отражаются в биоэлектрической активности, декодирование которой позволяет построить значительно более точные и специфичные DTIP по сравнению с классическими подходами. Нейросетевой алгоритм эффективно распознает паттерны нейрональной реакции и может идентифицировать вещество как по механизму действия, так и терапевтическому эффекту.
Перспективность решения также обусловлена возможностью дополнительного повышения производительности и точности за счет использования клеточных культур и срезов мозга с применением планарных мультиэлектродных матриц высокого разрешения [3].
Новизна данного исследования заключается в разработке нового подхода к прогнозированию фармакологических свойств. Реализован уникальный сценарий использования искусственных нейронных сетей и проведена их структурно-параметрическая оптимизация для решения задач по изучению психоактивных соединений. Впервые успешно выполнена классификация электрофизиологических сигналов на фоне действия различных психотропных средств с помощью методов глубокого обучения, то есть определена качественная принадлежность вещества к фармакологической группе на основании анализа данных мозговой активности.
Научное обоснование. Взаимосвязь биоэлектрической активности мозга с действием препарата наилучшим образом прослеживается на нейромедиаторно-рецепторном уровне [4], в пределах которого выявляется сложная структура внутренних взаимодействий (интерактивная фигура 2). Клинический эффект соединения каузально вторичен по отношению к его механизму действия [5]. Поэтому одинаковой активностью, например, противосудорожной или седативной, могут обладать вещества с различными механизмами действия и четко дифференцируемым влиянием на биоэлектрическую активность, что было показано на первом этапе исследований с карбамазепином и фенобарбиталом. Взаимосвязь электрической активности мозга с химическим строением соединения также полностью опосредована его механизмом действия [6]. Таким образом, электроэнцефалографические характеристики препарата имеют максимальную взаимосвязь с фармакологической мишенью, которая оказывает непосредственное влияние на нейрональную активность и электрохимическую передачу импульсов.
Поскольку ЭЭГ-сигнал генерируется преимущественно кортикальными пирамидальными нейронами [7], а действие препарата может реализоваться на разных уровнях ЦНС [8], при анализе сигнала следует учитывать структурную, функциональную и эффективную коннективность заинтересованных отделов мозга (интерактивная фигура 3). Применение интрацеребральных микроэлектродов позволяет оценить динамику активности отдельных центров мозга на фоне действия психотропных средств, а также проследить функциональные и эффективные связи, имеющие как более общий (присущий фармакологической группе, объединенной эффектом), так и более специфический характер (проявляющийся только в отношении отдельных веществ), с обязательным принятием во внимание индивидуальных особенностей особи (пол, возраст и др.), а также внешних факторов и стимулов различной модальности [9][10].
Технико-экономическое обоснование строится на значительном сокращении трудоемкости экспериментальных работ по сравнению с классическим подходом, который требует проведения широкого ряда тестов, специфичных для узкого спектра фармакологических свойств.
Полимодальность и высокая точность “EEG-mediated DTI” подхода детерминируют кардинальный прирост продуктивности исследования при сопутствующем снижении временных и материальных затрат. С учетом отсутствия ключевых ограничений, свойственных современным методам прогноза активности in silico, предложенный подход представляется экономически целесообразным, перспективным и симультанно эффективным решением.
Переместите элементы фигуры мышью.
Интерактивная фигура 1. Нейропсихотропные препараты, объединенные по признаку фармакологического эффекта. [расширенное описание доступно только авторизованным участникам проекта]
Интерактивная фигура 2. Фармакодинамические взаимосвязи между различными нейромедиаторными системами головного мозга. [расширенное описание доступно только авторизованным участникам проекта]
Интерактивная фигура 3. Многоуровневая карта коннективности отделов головного мозга. [расширенное описание доступно только авторизованным участникам проекта]
Data acquisition
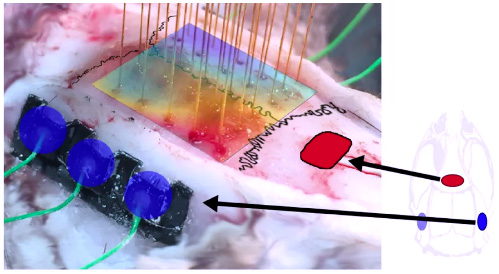
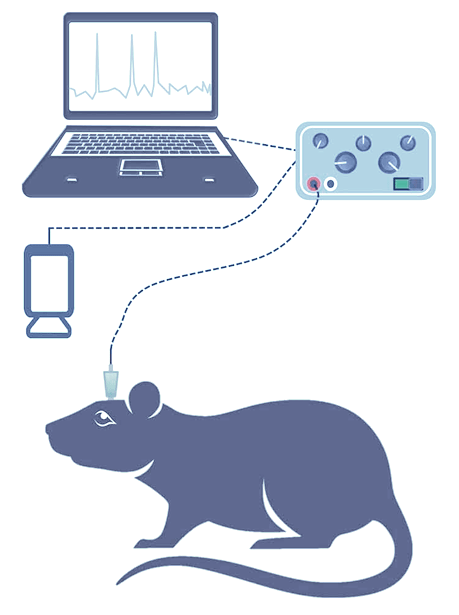
Регистрация электрической активности мозга выполняется с использованием мультиканальных интракраниальных электродных матриц, размещенных суперкортикально, либо с помощью винтовых электродов из хромисто-сталистого сплава эпидурально. Также планируется применение специально изготовленных транскраниальных планарных массивов микроигл. Изоляция электродов и основа выполнены из биосовместимого материала, что делает их пригодными для хронической имплантации. Внешне сигналы выводятся через совместимые коннекторы Omnetics или Samtec и далее подаются по экранированному кабелю на коммутационный блок лабораторного усилителя NVX-36 (МКС) или систему регистрации данных MP-160 (Biopac).

Субдуральный 32-канальный мультиэлектродный массив (Neuronexus)
Коннектор (Samtec или Omnetics) фиксируемый на черепе
Примечание: для получения справки наведите курсор на интерактивный элемент.
Цель и дизайн
Текущая цель: определение механизма действия и фармакологических свойств новых психотропных веществ на основе анализа биоэлектрической активности мозга с помощью алгоритмов машинного обучения.
-
Запуск динамической системы менеджмента научным проектом для планирования, организации и координации исследований
-
Оптимизация конструкции электродов, процедуры имплантации, координат, схемы введения веществ до получения сигнала с требуемыми параметрами.
-
Предварительная регистрация электрической активности с целью расчета необходимых объемов выборки, продолжительности регистрации, выявления негативных факторов, искажающих сигнал, коррекция дальнейшей стратегии научной работы.
-
Оценка специфичности реакции с целью формирования критериев отбора особей для изучения сигнала. Аугментация. Фильтрация. Кластеризация сигнала. Структурно-параметрическая оптимизация. Функциональные пробы.
-
Классификация веществ с неизученным механизмом действия. Репозиционирование известных препаратов.
-
Валидация механизма действия и фармакологических свойств на классических моделях
- I этап: ЭЭГ
- II этап: ЭКоГ
- III этап: LFP, MUA, SUA
- IV этап: Patch clamp
На первом этапе регистрировалась ЭЭГ. Были использованы алгоритмы машинного обучения для классификации эффектов противосудорожных средств – фенобарбитала и карбамазепина.
- Микроэлектроды
- Local field potential
- Multi-unit activity
- Single-unit activity
Описание III этапа доступно только авторизованным участникам проекта.
Метод локальной фиксации потенциала.
Описание IV этапа доступно только авторизованным участникам проекта.
Методика ЭКоГ
Опыты выполняются на имбредных крысах-самцах, массой 190–230 г и мышах-самцах, массой 18-22 г. Животные содержатся в стандартных условиях вивария (температура воздуха 23 ± 2 °С, непрерывная приточно-вытяжная вентиляция, санитарный контроль) при свободном доступе к воде и корму (ГОСТ Р 50258-92), 12/12-часовом режиме освещения и темноты с учетом рекомендаций Европейской конвенции о гуманном обращении с лабораторными животными.
Изготовление электродов
Электроды изготавливались путем обработки активным флюсом (паяльная кислота, Solins) и спаивания (олово 60%, свинец 40%) медного посеребренного проводника (260 мкм, длина 15 мм, РК 50-7-22) с медным кабелем (МГТФ 0.03, длина 20-30 мм) и контактом-гнездом из фосфористой бронзы, покрытой оловом (BL-T, сопротивление менее 0.01 Ом). Электроды монтировались в 8-канальное гнездо (BLD-8, стеклонаполненный нейлон). Посеребренный электрод покрывался биосовместимым самотвердевающим полимером (Протакрил-М) (v3), либо использовался термоусадочный полиолефин (v5) в качестве изоляции и окклюзионного ограничителя при погружении электрода в краниостому. В корпусе коннектора выполнялось сквозное крепежное отверстие, диаметром 1 мм, а также наносились риски у основания коннектора для повышения адгезии с полимерным цементом. Осуществлялась контрольная прозвонка проводящих частей. Готовому изделию присваивался идентификационный номер.
Хирургическая процедура имплантации
-
Убедиться в доступности всех препаратов, инструментов и готовности оборудования для проведения эксперимента. Подготовить р-р хлоралгидрата из расчета 400 мг/кг (или уретан 1,2-1,5 мг/кг), изофлюран (для премедикации), спирт этиловый, раствор перекиси водорода, воду дистиллированную, физ. раствор; хирургические инструменты (краниотомические фрезы, распатор, иглодержатель Гегара, пинцет, зажим, ножницы, ранорасширитель, хирургические иглы, скальпель); обработать электроды и фиксирующие винты в спиртовом растворе; подготовить стереотаксис, фиксатор для крыс, расходный материал;
-
Выбор животного, осмотр на наличие патологии.
-
Проведение общей анестезии хлоралгидратом 400 мг/кг в/б (или уретан 1,2-1,5 мг/кг) с помощью инсулинового шприца.
-
Фиксация животного в стереотаксисе после полного погружения в наркоз. Закапываем в глаза физ.р-р (или вазелин) для предотвращения иссушения роговицы и слизистой.
-
В области предполагаемого разреза кожи на голове удалить шерсть с помощью ножниц.
-
Обработка операционного поля р-ом йода. Скальпелем сделать продольный разрез кожи длинной 2-2,5 см по средней линии головы в ростро-каудальном направлении. С помощью хирургических пинцетов или зажимов раздвинуть кожные лоскуты и зафиксировать ранорасширителем. Освободить скальпелем или распатором кость от надкостницы, осушить ватным тампоном до четкого проступания швов свода черепа. Закоагулировать кровоточащие сосуды.
-
Нахождение ориентировочных точек: bregma (пересечение сагиттального и коронарного швов) и lambda (пересечение сагиттального и затылочного швов). Намечаем точки трепанационных отверстий.
-
С помощью стоматологического бора (фрезу обработать перекисью и спиртом) выполняем краниотомию (трепанационные отверстия 1 мм) в намеченных точках, периодически прерываясь,чтобы исключить нагревание кости.
-
Устанавливаем 2 фиксирующих электрода. Крепим коннектор к манипулятору стереотаксиса и подводим к своду черепа на длину электродного кабеля. Погружаем регистрирующие электроды на глубину 2 мм.
-
Фиксируем электроды самотвердевающим полимерным цементом с помощью специальных кювет. После затвердевания подводим коннектор непосредственно к своду черепа и заливаем цементом по периметру коннектора.
-
Промываем обнаженные ткани хлоргексидином. Ушиваем дистальные части разреза с помощью простых узловых швов, избегая перенатяжения мягких тканей головы.
-
Закрываем коннектор с помощью обтекаемого пластикового колпака для защиты от загрязнения и механических повреждений.
-
7 дней реабилитации на стандартном режиме питания и освещения. АБ терапия через день.
Примечание: для получения справки наведите курсор на интерактивный элемент. Слева представлена процедура транскраниальной имплантации мультиэлектродной матрицы; в центре – позиция регистрирующих электродов (ЭКоГ); справа – схема монтажа.
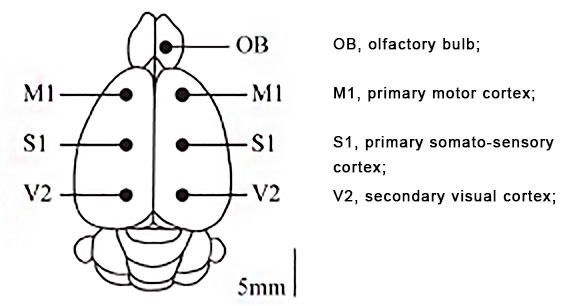
Координаты электродов
| Рострокаудальный уровень | Слева | Справа | |
|---|---|---|---|
| Обонятельные луковицы | Фиксирующий винт FS (6,60; 2,00) | Земля OB (6,60; -2,00) | |
| Первичная моторная кора | M1(A1) (0,00; 2,00) | M1(A2) (0,00; -2,00) | |
| Первичная соматосенсорная кора | S1 (P3) (-4,08; 2,00) | S1(P4) (-4,08; -2,00) | |
| Вторичная зрительная кора | V2(O1) (-7,08;2,00) | V2(O2) (-7,08;-2,00) | |
| Мозжечок | FS (0; -11,64) | ||
Регистрация ЭКоГ
Для записи биоэлектрической активности использовался гибкий многоканальный адаптер BLD-8M to DB-25M длиной 2 м.
После 7 дней реабилитации у каждого животного регистрировалась фоновая активность (продолжительность 60 мин., частота дискретизации 2000 Гц, биполярный монтаж, импеданс < 10 кОм) в условиях искусственного освещения под контролем оператора. После введения вещества (водная суспензия или раствор 2-3 мл с помощью желудочного зонда) в течение 60 мин. регистрировалась динамика развития эффектов. Через 2-3 часа после введения (в зависимости от фармакокинетических свойств препарата) проводилась запись пиковой активности на протяжении 60 мин. Введение нового препарата производилось не ранее чем через 4 периода полувыведения для исключения взаимодействия и остаточных эффектов.
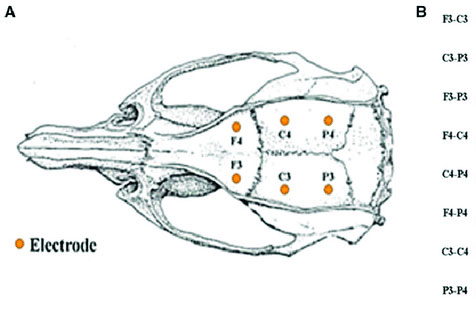
Схема монтажа
OB (GND)
S1 (P3) – M1 (A1)
V2 (O1) – M1 (A1)
S1 (P4) – M1 (A2)
V2 (O2) – M1 (A2)
Исходные данные загружались в облачное хранилище, сведения о проведенной процедуре заносились в онлайн-журнал.
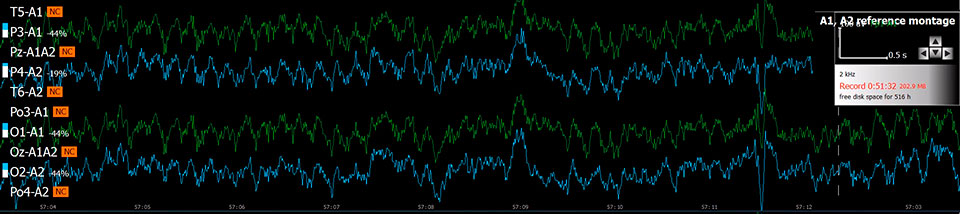
Эффект хлорэтила (непрерывная запись 90 с)
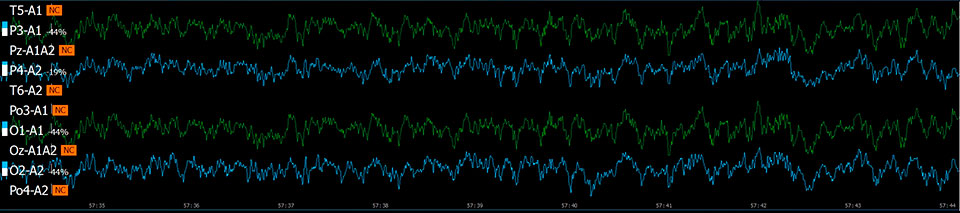
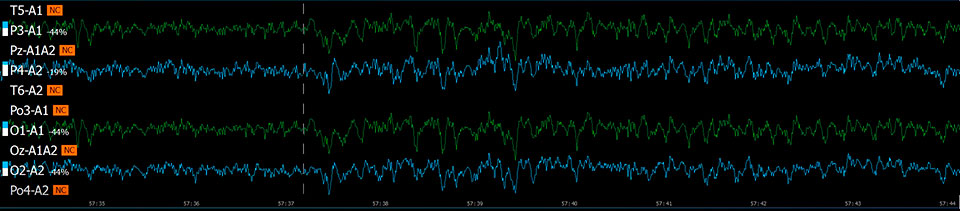
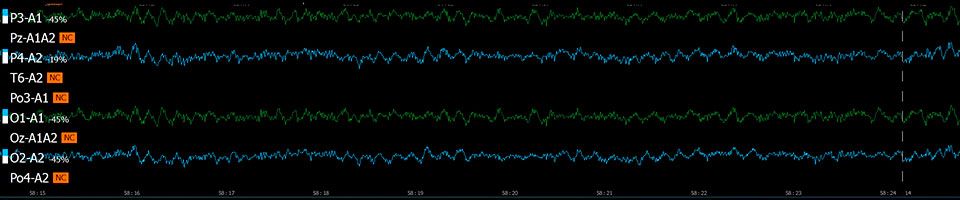
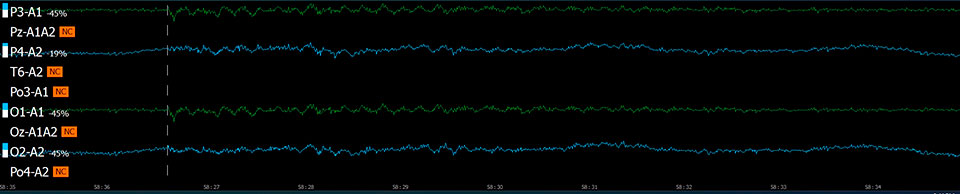
Исследуемые вещества
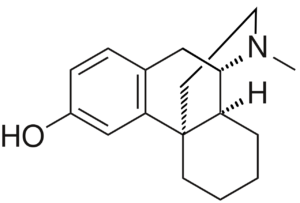
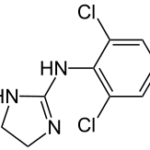
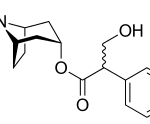
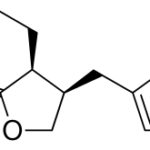
Текущий этап предполагает увеличение разнообразия референтных фармакологических групп и соединений для формирования репрезентативной обучающей и валидационной выборок. Тестовая выборочная совокупность будет сформирована из новых соединений, которые проявили психотропную активность, но механизм их действия остается недостаточно изученным.
Исследуемые вещества вводились перорально в максимальной однократной терапевтической дозе с коэффициентом пересчета 5.9 для крыс [Т.А. Гуськова, 2010].
Методы анализа
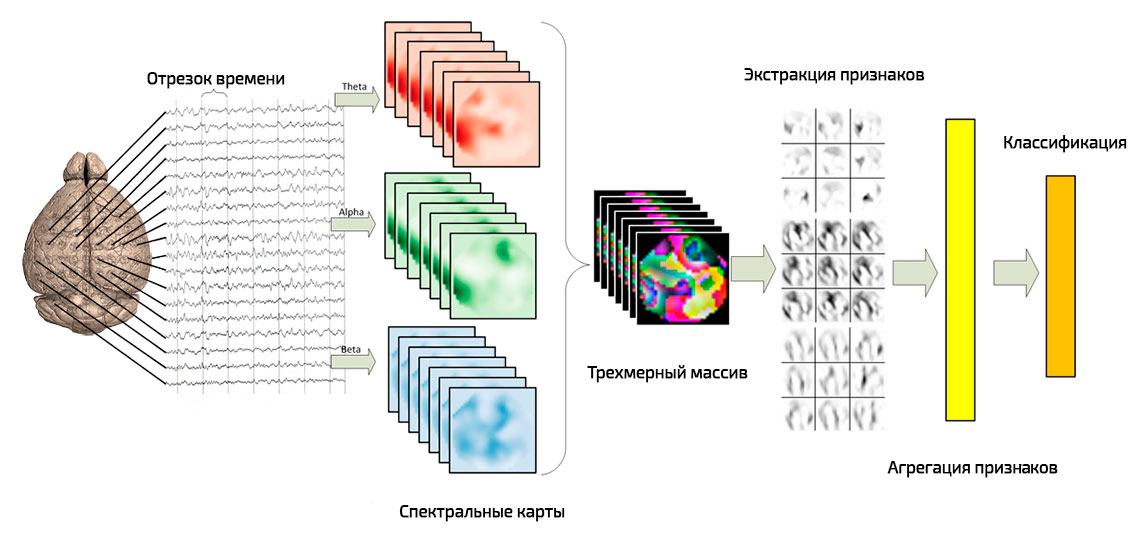
Рисунок 1. Поэтапный процесс классификации электроэнцефалограмм с помощью конволюционной нейронной сети. [расширенное описание доступно только авторизованным участникам проекта]
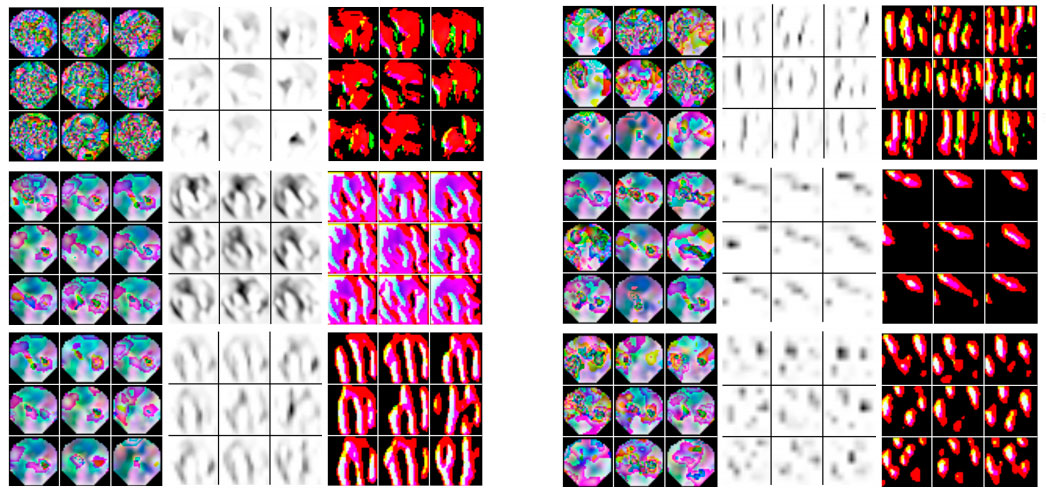
Рисунок 2. 1) графический входной вектор; 2) карты признаков; 3) обратная проекция. [расширенное описание доступно только авторизованным участникам проекта]
Фундаментальные закономерности
Timeline
- Завершена научная публикация: Deep learning-based i-EEG classification with convolutional neural networks for drug-target interaction prediction
- Завершена регистрация сигналов по дополнительным веществам-аналогам
- Заключительный этап тестирования и структурно-параметрической оптимизации архитектур нейронных сетей на модельных сигналах
- Включение в обучающую выборку веществ-аналогов для валидизации результатов кластеризации
- Публикация алгоритмов на GitHub для открытого бета-тестирования
- Возобновление работы по проекту после вынужденного перерыва, связанного с осложнением эпидемиологической ситуации (COVID-19)
- Регистрация ЭКоГ на фоне действия новых соединений с анксиолитической и противосудорожной активностью.
- Завершена запись сигналов биоэлектрической активности для препаратов тестовой выборки (по 5 особей на каждое вещество)
- Сборка, настройка, запуск и калибровка оборудования для эксперимента по методике локальной фикасации потенциала.
- Регистрация ЭКоГ (суммарно 27 часов, 8 веществ)
- Имплантация электродов v5 (6 животных)
- Регистрация ЭКоГ (суммарно 35 часов, 8 веществ)
- Имплантация электродов v5 (3 животных)
- Оптимизация архитектуры НС
- Аутопсия (1 животное)
- Регистрация ЭКоГ
- Имплантация электродов v5 (1 животное)
- Оптимизация архитектуры НС
- Дополнение вводной части проекта
- Дополнение данных по веществам (Т1/2, дозировки, приоритизация)
- Инфографика для наглядного представления дизайна исследования
- Новый шаблон для коллаборативного оформления протоколов лабораторных исследований
- Доработка конструкции регистрирующего шлейфа
- Аутопсия 1 животного
- Анализ данных, составление отчета
- Подготовка иллюстрированного пособия по анатомии мозга крысы
- Регистрация ЭКоГ
- Техническое обслуживание стереотаксисической системы
Tweak: Improved scroll-spy functionality in Table of Contents
Модифицирован код /assets/js/frontend.min.js
span[id*=”anchor”] {
padding-top: 50px;
margin-top: -50px;}
- Исправлена ошибка отображения description в gallery /elementor-pro/modules/gallery/widgets/gallery.php string 1407 ‘large’ replaced by ‘full’
- Исправлено отображение данных в таблице span.footable-toggle.fooicon.fooicon-plus {display: inline; vertical-align: middle;}
- Добавлена навигация по странице
- Регистрация активности на фоне коразола 25 мг/кг, п.к.
- Аутопсия 1 животного
- Имплантация (2 опытных животных, электроды v5 с полиолефиновыми ограничителями)
- Сборка и прозвонка электродных комплексов
- Регистрация ЭЭГ (амитриптилин-фон)
- Изготовление 90 электродов
- Аутопсия 2 животных
- Контрольная проверка качества сигнала всех опытных животных
- Тестирование изофлюрана в качестве ингаляционного наркоза
- Разработка новой конструкции электродов с полиолефиновыми заглушками
- Разработка новой конструкции электродов с силиконовыми заглушками
- Установка пластиковых обтекаемых колпаков для защиты коннекторов от загрязнений и механических повреждений
- Контрольная проверка качества сигнала и состояния коннекторов
- Реставрация коннекторов после механических повреждений
- Регистрация фоновой ЭЭГ
- Аутопсия 1 животного
- Защита коннекторов от механических повреждений с помощью установки металлических зажимов
- Имплантация (3 опытных животных)
- Аутопсия 2-х животных
- Изготовление шлейфа для регистрации сигнала
- Имплантация (5 опытных животных, РГ-2)
- Имплантация (3 опытных животных, РГ-2)
- Изготовление 140 эпидуральных микроэлектродов (нить 260 мкм)
- Имплантация (1 пробное животное, коннектор DE-9, РГ-2)
- Модернизация хирургической процедуры установки электродов (сокращение времени имплантации с 4 часов до 1,5 часов на 1 животное)
- Окончательный выбор конструкции и монтажа микроэлектродов на основании полученных данных
- Планирование экспериментальных работ (на 25 животных)
- Аутопсия (1 животное, RJ-45)
- Анализ полученных данных
- Составление отчета
- Эвтаназия и патологоанатомическое исследование (1 животное)
- Изготовление электродов
- Разработка схемы введения веществ
- Регистрация ЭКоГ на фоне действия амитриптилина
- Изготовление электродов
- Имплантация эпидуральных электродов (1 пробное животное)
- Регистрация биоэлектрической активности на фоне хлорэтила
- Патологоанатомическое исследование
- Анализ данных
- Составление отчета
- Апробация универсальных коннекторов (RJ-45, VGA, BD-10, BLD-8) для хронической фиксации на черепе
- Имплантация электродов (2 пробных животных)
- Изготовление модифицированных эпидуральных электродов
- Закупка расходников
- Регистрация биоэлектрической активности
- Патологоанатомическое исследование
- Анализ данных
- Составление отчета
- Модернизация электродов
- Имплантация электродов (2 пробных животных)
- Освоение и калибровка параметров вводного ингаляционного наркоза
- Выбор оптимальной схемы антибиотикотерапии
- Изготовление электродов
- Регистрация биоэлектрической активности
- Патологоанатомическое исследование
- Анализ данных
- Составление отчета
- Закупка биосовместимого полимерного цемента “Протакрил-М”
- Теоретическая подготовка
- Анализ полученных данных, коррекция электродных координат
- Операция по имплантации электродов (1 пробное животное)
- Составление отчета
- Регистрация и визуальный анализ ЭКоГ на фоне хлороформа
- Аутопсия пробного животного
- Составление отчета
- Закупка фиксирующих винтов из нержавеющей стали
- Поиск биосовеместимых полимерных материалов для фиксации электродов
- Теоретическая подготовка рабочих групп
- Литературный обзор
- Закупка акрилового клея, серебряных электродов, расходников для операции
- Транскраниальная имплантация электродов (1 пробное животное). Отработка навыков оперативной микрохирургии.
- Освоение методики внутривенного и внутрибрюшинного введения.
- Запуск системы управления научными проектами https://cmi.bitrix24.com/
- Теоретическая подготовка рабочих групп
- Пробная операция по установке электродов
- Адаптация метода имплантации электродов
- Литературный обзор
- Формирование подготовка рабочих групп РГ-1 и РГ-2
- Подготовка инструментов и оборудования к запуску эксперимента
- Распределение задач по направлениям
- Обобщение литературных данных
- Добавлено подробное описание графического материала
- Вывод обзорных данных в форме интерактивных схем
- Актуализирован спектр задач
- Предварительные результаты латентно-семантического анализа:
- Семантическая близость нейромедиаторных систем
- Семантическая близость отделов мозга в контексте фармако-ЭЭГ
- Семантическая близость нейропсихотропных средств в контексте фармако-ЭЭГ
- Устранена ошибка lightbox для изображений в таблице
- Схематичное представление анализа ЭЭГ с помощью рекуррентно-конволюционной нейронной сети.
- Сбор данных по фармакодинамическому взаимодействию нейропсихотропных веществ и их отражение в ЭЭГ динамике (подготовка интерактивной фигуры)
- Дополнено описание фармакологической части
- Вывод формул в формате LaTeX
- Описано регистрирующее оборудование и хирургические методы
- Формулировка задач по лит. обзору
- Описание фармакологической части
- Верстка главной страницы проекта
- Финитизация временных рамок основных этапов
- Завершен отчет I итерации научных исследований
- Планирование II этапа
- Реализована библиотека интерактивных фигур