Подавляющее большинство нейрофизиологических исследований биоэлектрической активности нейронов основаны на измерениях внеклеточного напряжения (т.е. разницы потенциалов между двумя точками биологической среды).1 Колебания внеклеточного напряжения представляют собой эндогенное электрическое поле и отражают активность большого количества нейронов.2
Биоэлектрическая активность головного мозга является переменной величиной, изменяемой под действием различных внешних и внутренних раздражителей, таких как колебания уровня внимания, эмоционального состояния, а также особенностей метаболизма. Эти изменения позволяют характеризовать адаптационные возможности ЦНС и моделировать ее поведение в различных ситуациях.
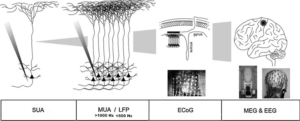
Биоэлектрическая активность нейронов наблюдается во всей центральной нервной системе на всех уровнях организации. Условно выделяют три уровня: микроуровень (активность отдельного нейрона), мезоуровень (активность локальной группы нейронов) и макроуровень (активность разных областей мозга).
➥ Основная статья: Функциональные системы, структура и организация мозга
По уровням организации мозговой активности и способам ее регистрации выделяют:
I. Микроуровень
- Patch clamp метод – позволяет регистрировать биопотенциалы изолированных нейронов;
- SUR (англ. singleunit activity recording – запись активность одиночного нейрона) – на уровне отдельных нейронов; Примером активности одиночного нейрона являются вспышки (англ. bursts) – множественные последовательные потенциалы.
II. Мезоуровень
- MUR ( англ. multiunit activity recording) – мультиюнитная активность;
- LFP (англ. local field potential) – локальный полевой потенциал;
- ЭКоГ
- ЭЭГ
- МЭГ
III. Макроуровень
- LFP (англ. local field potential – локальный полевой потенциал);
- ЭКоГ
- ЭЭГ
- МЭГ
Исследование биоэлектрической активности нейронов
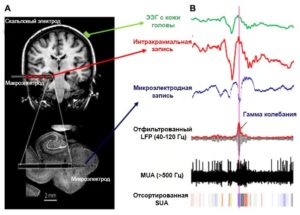
К основным методам регистрации биоэлектрической активности нейронов головного мозга на разных уровнях организации относятся электрофизиологические методы, к примеру, микроэлектродные методики, электроэнцефалографию (ЭЭГ), магнитоэнцефалографию (МЭГ).
На мезоуровне, где можно анализировать локальные популяции нейронов, популярным методом является внеклеточная запись с использованием металлических электродов. Электрод, помещенный в срез мозга in vitro или имплантируется в мозг in vivo регистрирует электрические сигналы, производимые окружающими клетками. Таким образом можно наблюдать широкий спектр нейронной активности, от спайковой активности отдельных нейронов (активность одиночного нейрона (SUA) в виде внеклеточного потенциала действия (EAP); полоса пропускания: 300-3000 Гц) до более медленных колебаний небольших нейронных популяций (мультиюнитная активность или MUA; потенциалы локального поля или LFP; полоса пропускания: 1- 300 Гц).
Стандартное количественное исследование выполняется путем расчета спектрального распределения мощности длительных записей, то есть относительных амплитуд различных частот, составляющих сигнал. В целом полученные сигналы имеют широкое спектральное содержание, здесь можно обнаружить ритмическую активность, которая генерируются на определенных частотах, и сосуществующую с ней шумовую (нерегулярную) активность.34 Они могут наблюдаться в разных масштабах: от активности одного нейрона до скоординированной деятельности крупных нейронных ансамблей.
Методы регистрации нейронной активности
Микроэлектродные методики в основном применяются для исследования активности нейронов на микро- и мезо- уровнях организации мозга и может проводится как внутри-, так и внеклеточно.
➥ Основная статья: Микроэлектродный метод измерения мембранного потенциала
Внутриклеточная активность отдельных нейронов фиксируется, когда поверхностная мембрана клетки оказывается между регистрирующим (расположенным внутри клетки) и относительным электродом (вне клетки), что приводит к отведению постоянной разности потенциалов в несколько десятков милливольт.
Внутриклеточная активность
- Спайк (англ. spike);
- Синаптичский потенциал (англ. synaptic potentail);
- Подпороговые колебания мембранного потенциала;
При внеклеточном отведении регистрирующий электрод фиксирует изменения потенциала с внешней стороны клетки по отношению к индифферентному электроду, расположенному на удалении (напр., на поверхности ткани); такой электрод можно рассматривать как имеющий постоянный нулевой потенциал.
Внеклеточная активность
- Вызванный возбуждающий постсинаптический потенциал поля (англ. evoked field excitatory-postsynaptic potentials, fEPSP);
- Активность одиночного нейрона (SUA) спайковая/ПД;
- Мультиюнитная активность-спайковая;
- Не спайковый, деполяризующий потенциал (ЭЭГ).
Patch clamp метод
➥ Основная статья: Patch clamp метод
Это лабораторный метод в электрофизиологии, используемый для изучения ионных токов в отдельных изолированных живых клетках, срезах тканей или небольших участках клеточной мембраны нейронов. Этот метод особенно полезен при изучении возбудимых клеток, что производится посредством специальной стеклянной пипетки (patch-пипетки), напоминающей микроэлектрод, но имеющей сопротивление от 2 до 10 МОм в зависимости от типа исследуемых клеток.
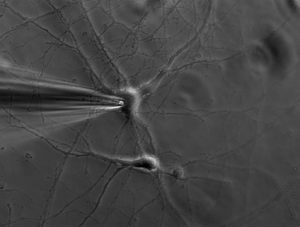

Запись активности одиночного нейрона (SUR)
➥ Основная статья: Активность одиночного нейрона
Электрическая активность одиночного нейрона связана с формированием нервных импульсов, которые передаются посредством потенциала действия. Потенциал действия – это не что иное, как временный сдвиг (от отрицательного к положительному) мембранного потенциала нейрона, вызванный потоками ионов изнутри и внутрь клетки. Он обусловлен наличием в клеточной мембране особых типов потенциалзависимых ионных каналов (натриевые и калиевые). Потенциалзависимые натриевые каналы относятся к типам каналов, способных создавать положительную обратную связь, необходимую для создания потенциала действия, т.е. мембранный потенциал управляет состоянием ионных каналов, как и состояние ионных каналов управляет мембранным потенциалом. Они отвечают за быстрые потенциалы действия, участвующие в нервной проводимости.
Запись электрической активности одиночных нейронов (англ. singleunit recording) проводится при помощи микроэлектродов. Когда нейрон генерирует потенциал действия, сигнал распространяется вниз по нейрону как ток, который течет в клетку и выходит из нее через потенциалзависимые ионные каналы мембраны. Микроэлектрод имплантируется в мозг, где он может регистрировать скорость изменения напряжения относительно времени. Эти микроэлектроды должны быть с тонкими наконечниками и являться низкоимпедансными проводниками;5 в основном это стеклянные микропипетки, металлические микроэлектроды из платины, вольфрама, иридия или даже оксида иридия.678 Микроэлектроды осторожно размещаются близко к клеточной мембране, что позволяет проводить запись внеклеточно.
Записи с одиночных нейронов широко используются в когнитивистике, где они позволяют анализировать когнитивные способности человека и проводить картографирование коры. Затем эта информация может быть применена к технологиям интерфейса мозг-компьютер (BCI) для управления внешними устройствами.9
MUR
➥ Основная статья: Мультиюнитная активность
Так как регистрация активности отдельных нейронов не всегда возможна, в качестве замены выступает запись «мультиюнитной активности» (MUR). MUR позволяет отслеживать активность большого количества нейронов, однако при этом достаточно сложно отличить конкретные нейрональные подтипы, знание которых часто имеет решающее значение для понимания электрофизиологических процессов.
Если взять электрод с большей рабочей поверхностью, то он сможет регистрировать активность, генерируемую несколькими нейронами. Этот тип записи называют «мультиюнитной записью», ее часто используют на здоровых животных, для записи изменений активности в дискретной области мозга в спокойном состоянии. Записи с одного или нескольких таких электродов, расположенных на близком расстоянии друг от друга, можно использовать для определения количества клеток вокруг него, а также того, какой спайк исходят из какой клетки. Этот процесс называется сортировкой спайков и подходит для определения активности конкретных популяций нейронов с четко определенными характеристиками спайков.
LFP
➥ Основная статья: Потенциал локального поля
Потенциалы локального поля (LFP) представляют собой временные ритмические сигналы, генерируемые в нервной ткани посредством суммарной и синхронной электрической активности отдельных нейронов. LFP – это «внеклеточные» сигналы, означающие, что они генерируются временным дисбалансом концентрации ионов в пространствах вне клеток, в результате электрической активности клеток, при одновременной активации многих нейронов посредством синаптической передачи. LFP являются «локальными», потому что они регистрируются электродом, расположенным рядом с возбужденными нейронами. В результате закона обратных квадратов такие электроды могут регистрировать потенциалы только в пространственно ограниченном радиусе. Они являются «потенциалами», потому что генерируются напряжением, возникающим в результате разделения заряда во внеклеточном пространстве. Они «полевые», потому что эти внеклеточные разделения заряда по существу создают локальное электрическое поле. LFP обычно регистрируют с помощью высокоимпедансного микроэлектрода, размещенного в середине популяции клеток. Они могут быть записаны, например, с помощью микроэлектрода, помещенного в мозг анестезированного животного, или в тонкий срез мозга in vitro.
Микроэлектродные записи могут анализировать сигналы по низкочастотной активности (<250 Гц), называемой «потенциалом локального поля» (LFP), и более высокочастотной активности (> 250 Гц), называемой «мультиюнитной активностью» (MUA). Считается, что LFP представляет «суммированные» синхронные возбуждающие и ингибирующие постсинаптические события, в то время как MUA, как полагают, является результатом возбуждения нескольких нейрональных подтипов.10
ЭКоГ
➥ Основная статья: Электрокортикография
Электрокортикография (англ. electrocorticography, ECoG, ЭКоГ) становится все более популярным методом для изучения различных корковых явлений в клинических условиях. Он использует субдуральные платино-иридиевые или нержавеющие электроды для регистрации электрической активности непосредственно с поверхности коры головного мозга, минуя тем самым искажающий сигнал череп и промежуточную ткань. Пространственное разрешение зарегистрированного электрического поля может быть существенно улучшено (<5 мм²) с помощью гибких, близко расположенных субдуральных решетчатых или ленточных электродов.
ЭЭГ
➥ Основная статья: ЭЭГ
Электроэнцефалография (ЭЭГ) является одним из старейших и наиболее широко используемых методов исследования электрической активности мозга. Электроэнцефалограмма записанная с кожи головы, одним электродом, представляет собой пространственно-временную сглаженную версию потенциала локального поля (LFP), интегрированную на площади 10 см² или более. В большинстве случаев он имеет мало заметную связь со спайковой активностью отдельных нейронов, и это в значительной степени связано с искажающим и ослабляющим действием мягких и твердых тканей между источником тока и записывающим электродом. Недавно представленные записи ЭЭГ с «высокой плотностью» в сочетании с моделированием источника, которое может учитывать извилины и борозды (как это следует из структурной МРТ-визуализации) субъекта, существенно улучшили пространственное разрешение ЭЭГ.
МЭГ
В магнитоэнцефалографии (МЭГ) используются сверхпроводящие квантовые интерференционные устройства (SQUID) для измерения крошечных магнитных полей вне черепа (обычно в диапазоне 10–1000 fТ) от токов, генерируемых нейронами. Поскольку МЭГ неинвазивен и имеет относительно высокое пространственно-временное разрешение (~1 мс и 2–3 мм), он стал популярным методом мониторинга активности нейронов в мозге человека. Преимущество МЭГ состоит в том, что магнитные сигналы намного меньше зависят от проводимости внеклеточного пространства. Свойства масштабирования (то есть отношение частоты к мощности) ЭЭГ и МЭГ часто показывают различия, как правило, в высокочастотных диапазонах. Эти различия могут быть частично объяснены емкостными свойствами внеклеточной среды (например, кожи и мышц скальпа), которые искажают сигнал ЭЭГ, но не искажают сигнал МЭГ.
Footnotes
- A quantitative description of membrane current and its application to conduction and excitation in nerve. HODGKIN AL, HUXLEY AF J Physiol. 1952 Aug; 117(4):500-44. [PubMed]
- The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Buzsáki G, Anastassiou CA, Koch C Nat Rev Neurosci. 2012 May 18; 13(6):407-20. [PubMed]
- Nunez PL., Srinivasan R. Electric Fields of the Brain: the Neurophysics of EEG. 2nd ed. New York, NY: Oxford University Press. 2005 [Google Scholar]
- Self-organized criticality: An explanation of the 1/f noise. Bak P, Tang C, Wiesenfeld K Phys Rev Lett. 1987 Jul 27; 59(4):381-384.[PubMed]
- Cogan, Stuart F. (2008). “Neural Stimulation and Recording Electrodes”. Annual Review of Biomedical Engineering. 10: 275 –309. doi:10.1146/annurev.bioeng.10.061807.160518.
- Cogan, Stuart F. (2008). “Neural Stimulation and Recording Electrodes”. Annual Review of Biomedical Engineering. 10: 275–309. doi:10.1146/annurev.bioeng.10.061807.160518.
- Boulton, A. A. (1990). Neurophysiological techniques: applications to neural systems. Clifton, New Jersey: Humana Press.
- Maeng, Jimin; Chakraborty, Bitan; Geramifard, Negar; Kang, Tong; Rihani, Rashed T.; Joshi‐Imre, Alexandra; Cogan, Stuart F. (2019). “High‐charge‐capacity sputtered iridium oxide neural stimulation electrodes deposited using water vapor as a reactive plasma constituent”. Journal of Biomedical Materials Research Part B: Applied Biomaterials. doi:10.1002/jbm.b.34442.
- Mukamel, R; Fried, I. (2011). “Human Intracranial Recordings and Cognitive Neuroscience”. Annual Review of Psychology. 63 (1): 511–537. doi:10.1146/annurev-psych-120709-145401.
- The limited utility of multiunit data in differentiating neuronal population activity Corey J. Keller, Christopher Chen, Fred A. Lado and Kamran Khodakhah 2016 Apr 25. doi:10.1371/journal.pone.0153154