Потенциал локального поля (англ. local field potential, LFP) – низкочастотная составляющая (≲500Гц) внеклеточного потенциала, зарегистрированного в головном мозге внеклеточным электродом.
Введение
Электрические сигналы от кортикальной поверхности мозга животных были зарегистрированы еще в 1875 году.1 При дальнейших электрофизиологических исследованиях мозга выяснилось, что высокочастотная часть (выше ~ 500 Гц) записанных потенциалов дает информацию об импульсной активности нейронов, расположенных вокруг электрода. Напротив, часть сигнала с частотами ниже ~ 500 Гц, так называемый «потенциал локального поля», оказалось труднее интерпретировать с точки зрения лежащей в основе нейронной активности.
В связи с этим стали формироваться различные теории о происхождении данного типа активности мозга и о том что вносит вклад в ее формирование.
Первоначальная теория происхождения LFP – «теория кругового движения» (англ. circus movement theory), постулировала, что частота колебаний была обусловлена движением импульсов по петлям связанных нейронов.23 Экклс (1951) предположил, что активность LFP генерируется суммированными постсинаптическими потенциалами, возникающими в результате синхронного возбуждения нейронов.4 Внутриклеточные записи от корковых нейронов позже продемонстрировали тесное соответствие между активностью LFP и синаптическими потенциалами.567 Современная точка зрения состоит в том, что LFP генерируются синхронизированными синаптическими токами, возникающими в нейронах коры, возможно, посредством образования диполей.89
Геометрия
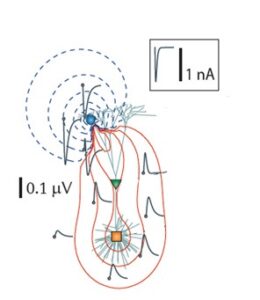
То, какие нейроны вносят вклад в LFP, определяется геометрической конфигурацией самих нейронов. В некоторых клетках дендриты обращены в одну сторону, а сома – в другую, например пирамидные клетки. Пирамидные клетки являются наиболее густонаселенным типом клеток. У них длинные толстые апикальные дендриты, которые могут образовывать сильные диполи вдоль соматодендритной оси. Такие диполи приводят к возникновению open field, поскольку существует значительное пространственное разделение активного стока (или источника) от обратных токов. Это вызывает значительный ионный поток во внеклеточной среде. Это известно как геометрическое расположение открытого поля. В нейронах, где дендриты расположены более радиально, разность потенциалов между отдельными дендритами и сомой имеет тенденцию компенсироваться диаметрально противоположными дендритами. В результате чистая разность потенциалов по всей клетке при одновременной активации дендритов имеет тенденцию быть очень малой. Таким образом, изменения потенциала локального поля представляют собой одновременные дендритные события в клетках в конфигурации открытого поля.10
Фильтрация нижних частот
Ранние исследования показали, что потенциалы действия имеют ограниченное участие в генезе LFP, что можно объяснить частотно-фильтрующими свойствами внеклеточной среды.11 Если среда действует как фильтр нижних частот, она подавляет высокие частоты (более чем ≈ 100 Гц), например, потенциалы действия, в то время как низкие частоты подавляться не будут – синаптическая активность. Таким образом, внеклеточные записи всегда показывают, что потенциалы действия регистрируются только для нейронов, непосредственно прилегающих к электроду, в то время как более медленные события, такие как синаптические потенциалы, по-видимому, распространяются и суммируются на большие расстояния.
Важно понимать, что тот факт, что спайки характерны только для клеток, лежащих в пределах нескольких микрон от электрода. Это является свойством, которое позволяет определять типы клеток.
Модели
Вычислительные модели объясняют как LFP, генерируемые популяциями корковых нейронов, зависят от положения электродов, дендритной морфологии синаптически активированных нейронов, а также от пространственного распределения и временных корреляций синаптической активности.
Генезис LFP – сложный вопрос, потому что LFP возникают из-за движения зарядов в очень извилистой внеклеточной среде, в которую встроены нейроны. Однако, как было выше сказано, помимо этой сложности, эта среда еще и является своего рода фильтром нижних частот. Обычная модель LFP, состоящая из набора источников тока, встроенных в однородную внеклеточную среду, не воспроизводит это фундаментальное свойство. Поэтому были разработаны теоретические модели, чтобы понять генезис такого частотно-зависимого затухания с расстоянием. Исходя из уравнений Максвелла, можно показать, что внеклеточный потенциал может демонстрировать частотно-зависимое ослабление, если внеклеточная проводимость неоднородна. В этом случае возникает индукция неоднородных плотностей заряда, что может привести к появлению фильтра нижних частот. Поскольку внеклеточное пространство представляет собой сложную совокупность процессов разной проводимости, таких как жидкости (внеклеточные и внутриклеточные) и мембраны (дендриты, аксоны, миелин, глиальные клетки и т. д.), его проводимость обязательно сильно неоднородна. Таким образом, теория показывает, что эти неоднородности составляют возможную физическую причину частотно-зависимых свойств LFP.12
Однако, хотя этот формализм и обеспечивает правдоподобное объяснение частотно-зависимых свойств LFP, его трудно применять на практике, потому что необходимо явно учитывать сложную трехмерную структуру внеклеточных процессов вокруг нейронов. Чтобы применить эти идеи к стандартному моделированию нейронов, необходимы упрощенные модели.
Первый подход предполагает, что источники тока являются точечными и окружены средой со сферически-симметричными градиентами проводимости / диэлектрической проницаемости вокруг каждого источника. Эта простая модель может отображать поведение фильтрации нижних частот, при котором быстрые электрические события (такие, как потенциалы действия, опосредованные Na⁺) очень круто затухают с расстоянием, в то время как более медленные (K⁺-опосредованные) события распространяются на большие расстояния во внеклеточном пространстве, что качественно согласуется с экспериментальными наблюдениями. Эта простая модель может быть использована для получения частотно-зависимых потенциалов внеклеточного поля без явного учета сложного складывания внеклеточного пространства.13
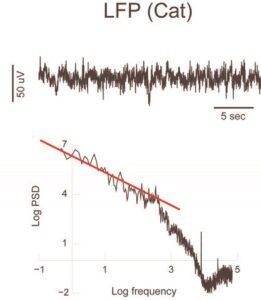
Явная структура внеклеточного пространства рассматривалась во втором типе модели.14 В этой модели внеклеточное пространство было аппроксимировано высокой плотностью сферических клеточных мембран, упакованных вокруг источника и погруженных в проводящую жидкость. Показано, что эти внеклеточные мембраны, если их рассматривать как пассивные (глиальные клетки), реагируют поляризацией. Из-за конечной скорости движения ионного заряда эта поляризация не будет мгновенной. Следовательно, индуцированное электрическое поле будет зависеть от частоты и значительно уменьшится для высоких частот. Эта модель предполагает, что (а) высокие частоты очень резко затухают и игнорируют соседние мембраны вокруг источников нейронального тока; (б) низкие частоты участвуют в последовательных поляризациях мембран и «переносятся» на гораздо большие расстояния.
Затем была исследована физическая основа частотного масштабирования 1 / f LFP. Многие сложные системы демонстрируют самоорганизованные критические состояния (SOC), характеризующиеся 1 / f-подобным спектром мощности. Однако, при анализе активности нейронов, не было обнаружено типичного степенного масштабирования состояний SOC («лавинный анализ»), который предполагает, что активность нейронов не происходит из критических состояний. Масштабирование LFP 1 / f можно объяснить с помощью модели, которая не полагается на критические состояния.15
На основе уравнений Максвелла был разработан макроскопический формализм, в который естественным образом включены макроскопические измерения диэлектрической проницаемости и проводимости. Исследование показывает, что ионная диффузия должна учитываться для согласования с частотной зависимостью электрических параметров, наблюдаемой экспериментально (помимо эффектов электрического поля). Те же механизмы также воспроизводят эффект частотной фильтрации 1 / f, описанный выше. Таким образом, эта модель предполагает, что данные физические причины могут объяснять частотную зависимость 1 / f локальных потенциалов поля без необходимости наличия критических состояний. Предсказания этой модели можно проверить экспериментально и в настоящее время исследуются.16
Эти и многие другие экспериментальные и модельные исследования показывают, что сигнал LFP по большей степени нетривиален, он может содержать значительный вклад от фильтрации через внеклеточную среду, ионной диффузии, поляризации клеток или эффектов, обусловленных неоднородностями проводимости. Что наиболее важно, LFP могут отражать в первую очередь вклад тормозных постсинаптических токов, что потенциально может иметь серьезные последствия для их интерпретации.
Регистрация LFP
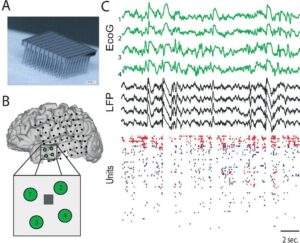
Потенциалы локального поля регистрируется во внеклеточном пространстве в ткани мозга с помощью микроэлектродов, помещенного в мозг анестезированного животного или в тонкий срез мозга in vitro. Для этого могут использоваться металлические (платино-иридиевые или вольфрамовые), кремниевые как одиночные, так и собранные в микроэлектродные матрицы, или стеклянная микропипетка.
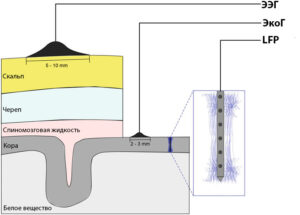
Распространенным предположением является то, что для регистрации LFP подходят электроды диаметром >50 мкм,17 но исследования показывают, что для записей LFP можно использовать микроэлектроды размером >16 мкм × 16 мкм.18 Тип монтажа отведений (моно- или биполярное) большого значения не имеет, т. к. оптимальная конфигурация достигается фильтрацией нижних частот в диапазоне от 200 до 400 Гц, которая все чаще выполняется в автономном режиме для «широкополосного» сигнала, обычно дискретизируемого с частотой >10 Гц.19 Исторически сложилось так, что электроэнцефалограмма является результатом регистрации биоэлектрической активности мозга с поверхности кожи головы. Электрокортикограмма была отнесена к аналогичной записи, полученной непосредственно из коры головного мозга, а потенциал локального поля был отнесен к активности, записанной при помощи электрода небольшого размера, вводимого в мозг. Все они являются основными записями постсинаптических потенциалов от разного числа популяций нейронов.20 Как одна из старейших методик, электроэнцефалография (ЭЭГ) широко используется в современных неврологических исследованиях.2122 Поскольку ЭЭГ регистрируется несколькими одиночными электродами на коже черепа и интегрируется на большой площади (10 см² или более), ее можно рассматривать как сглаженную пространственно-временную версию LFP.23 Из-за эффектов объемной проводимости сигнал, передаваемый от источника тока на регистрирующий электрод обычно ослабляется и искажается. В результате взаимосвязь между ЭЭГ и паттернами возбуждения участвующих нейронов в большинстве случаев неясна. Примечательно, что электрокортикография (ЭКоГ) все более и более активно применяется в клинических условиях и в исследованиях на животных.24 Регистрируя потенциалы непосредственно с поверхности коры, можно избежать искажения сигнала, прорходящего через череп и другие препятствующие ткани. Между тем, пространственное разрешение регистрируемого электрического поля может быть существенно улучшено (например, <5 мм²) за счет использования близко расположенных субдуральных сеток или полосовых электродов.25 В отличие от ЭЭГ и ЭКоГ, которые в основном регистрируют электрическую активность в поверхностном слое коры, LFP в основном измеряет электрическую активность в более глубоких слоях головного мозга. Вставляя тонкие микроэлектроды в мозг, LFP записывает широкополосный сигнал (постоянный ток до 40 кГц). Пространственное разрешение LFP очень высокое, так как расстояние между участками записи и источниками действительно небольшое, а микроэлектроды оказывают минимальное влияние на ткани мозга.26ЭЭГ, ЭКоГ и LFP
Footnotes
insights and beyond. Nat Rev Neurosci. 2005;6(1):35–47. doi: 10.1038/nrn1585.