Эпилепсия (лат. epilepsia) — это хроническое неврологическое заболевание, проявляющееся в предрасположенности организма к внезапному возникновению судорожных приступов.
Эпилепсией страдает около 50 млн человек, или 0,5-1% населения мира12(Hauser W.F. et al., 1993; Wolf P., 2006). Однако более 75% больных эпилепсией не получают адекватного лечения, и поэтому качество жизни пациентов остается неудовлетворительным3 (Yerbey, 2000; Карлов В.А., 2000, 2010; Wolf P., 2005). Актуальность изучения эпилепсий обусловлена высоким уровнем заболеваемости, тяжелой медико-социальной значимостью этих состояний не только для больного и его родственников, но и для общества в целом (Авакян Г.Н., 2010).
Механизм эпилептогенеза
Структурно-функциональные взаимоотношения являются важным аспектом при изучении эпилептогенеза, характеризуясь образованием патологических нейронных сетей с вовлечением в них интактных нейронных популяций. Концепция формирования патологических систем, особенно эпилептической и антиэпилептической, широко освещена в работах отечественных авторов456 (Карлов В.А., 2010; Степанова Т.С., Грачев К.В., 1976; Сараджишвили П.М., Геладзе Т.Ш., 1977; Крыжановский Г.Н., 1997, 2002).
Наши знания относительно механизмов эпилепсии в основном получены из экспериментов на животных. «Межприступные» спайки отражают синхронную деятельность многих сотен тысяч (или миллионов) нейронов. Избыток синхронизации может достигаться изменением баланса между возбуждением и торможением возбуждения. Это может происходить в результате увеличения возбуждения или уменьшения торможения или в результате обоих этих процессов. Внутриклеточные регистрации в корковых нейронах экспериментального эпилептического фокуса показали, что начальная компонента спайка сопровождается так называемым «пароксизмальным» сдвигом уровня деполяризации. Изменение уровня деполяризации создается возбуждающими постсинаптическими потенциалами, которые увеличиваются и последовательно усиливаются собственными потенциалзависимыми мембранными ответами. Увеличение может быть результатом разнообразных механизмов. Один из них — уменьшение внутрикоркового торможения. Это было недавно обнаружено при фокальной корковой дисплазии, которая с медицинской точки зрения является распространенной причиной тяжелой эпилепсии7.
Биообратные связи
Наличие повторных (рекуррентных) неспровоцируемых приступов является признаком эпилепсии как общего хронического неврологического заболевания. Эпилепсия — первое нарушение, для которого применялась нейротерапия. Было показано, что при некоторых типах эпилепсии, когда лечение не помогало или имело нежелательные побочные действия, БОС-тренинги 12—14 Гц активности сенсомоторной полосы достоверно уменьшали количество судорожных припадков. Барри Стерман из Калифорнийского университета в Лос-Анджелесе был первым, кто начал вводить этот метод в клиническую практику.
Эпилептология
Существует много различных типов эпилепсии, каждый из которых отличается собственной уникальной комбинацией форм приступов, возраста возникновения, ЭЭГ-коррелят, методов лечения и прогнозов. Регистрация ЭЭГ в случаях подозрений на эпилепсию сопровождается провоцирующими приступы процедурами, например, гипервентиляцией, фотостимуляцией и депривацией сна, пока судорожная активность не станет обнаруживаться визуально при просмотре ЭЭГ квалифицированными клиницистами. Метод же количественной ЭЭГ, который главным образом сосредоточен на оценке количественных параметров ЭЭГ в различных условиях, таких как спокойное бодрствование с открытыми и закрытыми глазами или во время решения различных задач, которые специально разработаны для исследования сенсорных и высших когнитивных функций мозга, таких как контроль и принятие решений, эмоции и память. Таким образом, анализ QEEG, главным образом, используется для исследования таких мозговых нарушений, как СНВГ, депрессии, шизофрения и др. Некоторые проблемы поведения (например, СНВГ) в редких случаях могут быть последствием наличия в коре эпилептогенного фокуса.
Диагностика эпилепсии
При эпилепсии электроэнцефалографическое исследование имеет особенно важное диагностическое значение. Специфика заболевания, проявляющегося периодическими приступами, возникающими часто на фоне общего благополучия и отсутствия клинической симптоматики, невозможность для врача в большинстве случаев, особенно у амбулаторных и впервые обращающихся больных, непосредственно видеть эпилептический припадок, амнезия, сопровождающая припадок, сильно затрудняют, а в ряде случаев делают невозможной клиническую диагностику без помощи электроэнцефалографии. Роль дополнительных объективных методов исследования тем более возрастает, что по определенным причинам социального порядка именно это заболевание нередко становится предметом симуляции или диссимуляции. Помимо этого, в ряде случаев встают серьезные дифференциально-диагностические задачи по разграничению эпилепсии и истерических или синкопальных приступов, а также расстройств сознания и поведения, связанных с другими заболеваниями.
В связи с этим при диагностике эпилепсии в процессе анализа ЭЭГ встают следующие основные вопросы: 1) диагностика собственно эпилепсии и дифференциации ее от других пароксизмальных заболеваний нервной системы; 2) определение типа эпилептических припадков или формы эпилептического заболевания; 3) отслеживание течения заболевания, корректировка лечения, прогноз.
➥ Более подробно читайте статью: Изменения ЭЭГ при эпилепсии
Тип припадка
Определение типа эпилептического припадка составляет комплексную клиническую задачу, которая не может быть решена только на основе анализа ЭЭГ. Это обусловлено, с одной стороны, тем, что в большинстве случаев у одного и того же больного могут комбинироваться различные типы эпилептических припадков, с другой стороны, тем, что не существует жесткой связи определенных клинических проявлений со «специфическими», присущими им проявлениями ЭЭГ. Тем не менее можно выделить некоторые типы ЭЭГ, которые статистически достоверно более часто связаны с некоторыми типами эпилептических приступов8.
➥ Более подробно читайте статью: Типы эпилептических припадков
Клинико-электроэнцефалографические характеристики основных эпилепсий и эпилептических синдромов
В 1989 г. ILAE представила Классификацию эпилепсий и эпилептических синдромов, ратифицированный Генеральной Ассамблеей ILAE. Классификация эпилепсий и эпилептических синдромов ILAE 1989 г. широко используется во всем мире, оказывая большое влияние на ведение пациентов с эпилепсий и научные исследования.
Рабочая группа по классификации типа приступов (Seizure Type Classification Task Force) была создана ILAE в 2015 г. А в 2017 г. разработана классификация приступов ILAE в двух вариантах – в виде базовой и расширенной версии9. Также была представлена и Классификация эпилепсии ILAE 2017 г., являющаяся первой развернутой Классификацией эпилепсии со времени ратифицированной ILAE Классификации 1989 г. Классификация эпилепсии ILAE 2017 г. является многоуровневой и предназначена для применения в клинической практике (см. рис. 3).
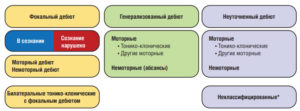
Примечание. * Вследствие недостатка информации или невозможности отнести к другим категориям.
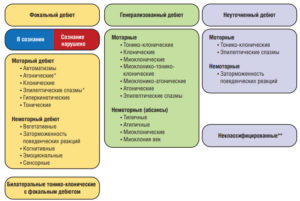
Примечания. * Состояние сознания обычно не определяется; ** вследствие недостатка информации или невозможности отнести к другим категориям
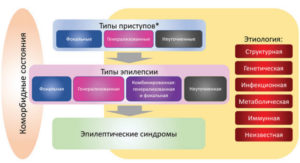
Примечание. * Оценивается по началу приступа.
Классификация эпилепсий и эпилептических синдромов 1989 года (ILAE)
- Парциальная эпилепсия
- Идиопатическая эпилепсия
- Симптоматическая эпилепсия
- Синдромы, характеризующиеся специфическим способом вызывания
- Синдромы по типу приступов
- Генерализованная эпилепсия
- Идиопатическая эпилепсия
- Доброкачественные судороги новорожденных, семейные и спорадические
- Доброкачественная миоклоническая эпилепсия в младенчестве
- Эпилепсия с пикнолептическими абсансами (пикнолепсия, эпилепсия с абсансами) детского возраста и юношеская эпилепсия с абсансами
- Юношеская миоклоническая эпилепсия
- Эпилепсия с генерализованными тонико-клоническими припадками
- Эпилепсии со специфическим способом вызывания
- Криптогенная эпилепсия
- Симптоматическая эпилепсия
- Идиопатическая эпилепсия
- Неопределенная эпилепсия
- Специальные синдромы
Отслеживание динамики заболевания, корректировка терапии, прогноз
Все перечисленные задачи тесно связаны между собой и их решение имеет значение на всех этапах ведения пациента, в отношении которого возникают проблемы, связанные с эпилепсией. В любом случае появлению клинических эпилептических припадков предшествует развитие в мозге гиперсинхронной нейрональной активности, вовлекающей несколько подсистем мозга, а следовательно, и сопровождающейся появлением эпилептиформной активности. В этой связи встает вопрос ее клинической оценки до появления эпилептических припадков. В этом отношении наблюдаются разноречия в тактике ведения таких пациентов с увлечением профилактической долгосрочной терапией фенобарбиталом в группах «риска эпилепсии», к каковым относят детей с фебрильными судорогами, лиц, перенесших операции на головном мозге, черепно-мозговые травмы, нарушения кровообращения, энцефалиты и менингиты и др. В последнее время, учитывая опыт практически неизбежного влияния любых противосудорожных препаратов на неврологические и высшие психические функции, возможность необратимых органических нарушений в ЦНС под их влиянием, развитие гепатопатий и других соматических расстройств, отмечается тенденция к отказу от их применения не только в профилактических целях, но и при наличии заведомых эпилептических припадков, когда они редки, не доставляют больному существенного дискомфорта и не представляют витальной опасности. Возникновение эпилепсии связано с многими факторами, и только суммарная их оценка может точно определить тактику ведения каждого отдельного больного. Такую статистически выверенную и научно и практически обоснованную оценку риска можно получить, учитывая совокупность признаков риска в приведенной нами выше системе «Эпидавр». Использование эпилептических индексов позволяет в каждом конкретном случае индивидуально решать вопросы необходимости назначения и длительности противосудорожной терапии. Общий принцип заключается в том, что при нулевой или первой степени риска, по данным количественной оценки ЭЭГ и клинических признаков, даже в присутствии одного или нескольких традиционных «факторов риска» профилактическое назначение противосудорожной терапии не показано. При второй степени риска противосудорожная терапия носит временный и симптоматический характер. Назначение ее обусловливается только наличием у больного поведенческих, вегетативных или психических отклонений, требующих фармакологической коррекции. Если эти отклонения носят приступообразный характер, то препараты группы вальпроата или карбамазепина, являющиеся эффективными психотропными средствами, оказываются одновременно и профилактически полезными в плане предотвращения эпилепсии. Длительность терапии в этих случаях определяется динамикой клинической картины, мерой и темпом исчезновения из ЭЭГ эпилептиформной активности. Формальным критерием прекращения дачи противосудорожных препаратов может быть переход пациента в первую или нулевую группу риска. Наконец, третья степень риска эквивалентна манифестации эпилепсии, и она требует длительной (не менее 2 лет) регулярной противосудорожной терапии.
После принятия решения о начале лечения подбор терапевтической дозы препарата следует проводить под контролем ЭЭГ. Если после достаточного увеличения дозы препарата не удается достичь полного прекращения приступов, рекомендуется повторное исследование. Отсутствие существенного уменьшения выраженности эпилептиформной активности и снижения электроэнцефалографического индекса риска эпилепсии может служить указанием на недостаточность дозы препарата или его неэффективность при данной форме болезни. Если после дополнительного увеличения дозы в течение более чем недели не наступает заметного уменьшения числа, тяжести припадков и улучшения на ЭЭГ, встает вопрос о смене препарата. В этих случаях нужно надежно проконтролировать правильность приема и исследовать содержание препарата в плазме крови больного и только при достаточно высоком его уровне в организме ставить вопрос о замене. Существуют различия двух основных противосудорожных препаратов: вальпроата и карбамазепина. В отношении первого имеется очень хорошая корреляция между клинической эффективностью и уменьшением выраженности эпилептиформной активности, а также снижением спектральной мощности в ЭЭГ. Поэтому при лечении вальпроатами следует коррегировать дозу в пределах терапевтической, добиваясь, по возможности, полного исчезнования патологической активности в ЭЭГ.
При лечении карбамазепином такой корреляции не наблюдается и возможны ситуации, когда при прекращении припадков эпилептиформная и (или) медленная активность в ЭЭГ остается, а иногда и усиливается, принимая генерализованный характер. В такой ситуации следует быть внимательным, поскольку это может служить признаком неэффективности карбамазепина у данного пациента. С другой стороны, при эффективном подавлении припадков не следует непременно добиваться полной нормализации ЭЭГ, памятуя правило лечить больного, а не ЭЭГ.
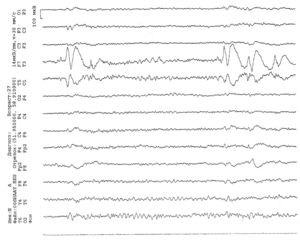
На дозе 12 мг/кг карбамазепина в левой височной области с проекцией между ТЗ и Т5 электродами регистрируется фокус постоянных комплексов острая волна-медленная волна до 270 мкВ амплитудой. Обратите внимание на извращение фазы в отведениях F7-T3 и Т5-О1.
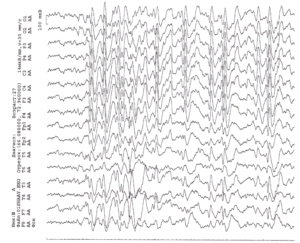
В ЭЭГ видны генерализованные разряды комплексов острая волна-медленная волна, острых и медленных волн до 350 мкВ амплитудой, билатеральносинхронных, попеременно асимметричных, но с преобладанием слева, продолжительностью до 20-30 сек. Картина ЭЭГ говорит о противопоказанности карбамазепина данному пациенту.
Единственным, но категорическим исключением из этого правила является синдром эпилептической афазии Ландау-Клеффнера. Поскольку у таких больных припадки могут отсутствовать, единственным клиническим критерием является восстановление речи, которое, если наступит, может быть значительно отставленным. Поскольку это восстановление прямо зависит от подавления эпилептической активности в мозге, то единственным прямым критерием эффективности лечения в его наиболее ответственной стадии служит динамика ЭЭГ. Учитывая, что нормализация работы мозговых механизмов формирования речи должна быть достигнута как можно быстрее, до развития необратимых нарушений коммуникации, исследования ЭЭГ следует проводить через возможно короткие интервалы, для оценки успешности терапевтических мероприятий. Задача — добиться полной нормализации ЭЭГ, что является условием восстановления и дальнейшего формирования речи (рис. 65).
Когда приступы полностью подавлены, нужда в повторных исследованиях ЭЭГ отсутствует. Исключение составляют сравнительно доброкачественные формы эпилепсии, имеющие тенденцию к спонтанному прекращению припадков при условии протекания их в мягкой форме. При этих формах иногда лечение можно прекратить на более ранних этапах. Это возможно при пикнолепсии (эпилепсии детского и юношеского возраста с типичными абсансами) и эпилепсии детского возраста с центро-темпоральными спайками без больших судорожных припадков. При этих формах эпилепсии ЭЭГ тесно коррелирует с числом и тяжестью приступов. Учитывая, что легкие короткие приступы могут протекать незаметно для больного, его окружения и врача, исследование ЭЭГ является точным и прямым критерием динамики заболевания. Динамические исследования ЭЭГ с интервалами не более 6 месяцев показаны в случаях тех же форм эпилепсии, когда по клиническим показаниям при редких и легких формах приступов принято решение воздержаться от назначения противосудорожных средств с самого начала. В этих случаях стойкость, постоянство и тем более нарастание выраженности эпилептиформной активности могут явиться показанием к назначению противосудорожных лекарств (например, по миновании острого периода после заболевания печени, явившегося противопоказанием к фармакотерапии). В вопросе о возможности воздержаться от лечения при малых припадках решающее значение имеет клиническая оценка степени нарушения сознания у пациента. В этих случаях эффективным приемом является регистрация реакции пациента нажатием на кнопку в ответ на сигнал (звуковой щелчок или короткую вспышку фотодиода), подаваемый исследующим в момент появления паттерна эпилептического разряда на ЭЭГ. Отметка раздражения и реакции производится противофазными прямоугольными выбросами на служебном канале электроэнцефалографа. Регулярные ответы на все предъявляемые стимулы являются более надежным критерием сохранности сознания и внимания пациента при субклиническом паттерне абсанса, чем проба с предъявлением слов для последующего припоминания, которая может быть нормальной при клиническом абсансе, во время которого больной не реагировал на стимулы нажатием на кнопку10.
Решающее значение имеют данные ЭЭГ при возникновении вопроса о прекращении противосудорожной терапии после длительной ремиссии. По существующим нормам, этот вопрос можно ставить не менее 2 лет спустя от последнего приступа. В этом случае попытка отмены препарата предпринимается обычно, если в ЭЭГ не обнаруживается патологических изменений в фоне и при пробах с фотостимуляцией и гипервентиляцией. В последнее время в связи с пересмотром целого ряда критериев «нормальности» в ЭЭГ11 считается возможным ставить вопрос об отмене при исчезновении в ЭЭГ типичных эпилептиформных феноменов, даже при сохранности неспецифических негрубых отклонений. В этом отношении уже неоднократно упоминавшаяся система количественной оценки клинико-электроэнцефалографических данных по степеням риска эпилепсии («Эпидавр») дает более надежный критерий. Поскольку большинство факторов риска, из которых слагаются индексы, имеют динамический характер, система позволяет гибко отслеживать динамику эпилептического процесса даже при отсутствии припадков. Согласно опыту использования, вопрос об отмене терапии можно ставить в случаях, если в ходе лечения наблюдалось снижение степени риска, и степень риска в момент постановки вопроса не более первой. Постепенное снижение дозировки препарата должно сопровождаться записями ЭЭГ, обычно не менее недели спустя от очередного снижения дозы, затем 1 и 3 месяца спустя после окончательной его отмены. Появление и усиление выраженности аномальных колебаний в ЭЭГ, а тем более эпилептиформной активности, является прямым показанием к увеличению дозы препарата до уровня, возвращающего ЭЭГ к исходной нормализации, и оставлению попыток отмены противосудорожной терапии до лучших времен. Аналогичное решение следует принять при нарастании степени риска эпилепсии, вычисляемой вместе с повторными оценками ЭЭГ.
С вопросами прогноза, оценки риска и диагностики эпилепсии связаны задачи врачебной экспертизы в профессиональной, страховой и судебной медицине. Следует сразу отметить, что электроэнцефалографист не имеет права и обязанности выносить окончательные экспертные суждения, и его данные являются только частичным вкладом в общую картину клинического состояния обследуемого. Невозможно дать единую систему рекомендаций, пригодную к каждому отдельному случаю, учитывая сложную комбинацию медицинских, психологических, профессиональных, экономических, юридических и, не в последнюю очередь, этических факторов.
При решении вопросов профессиональной пригодности обнаружение явных эпилептиформных феноменов в ЭЭГ, таких как паттерн эпилептического припадка или разряды эпилептиформной активности, являются достаточным основанием для отсева в профессиях, связанных с вождением транспорта, слежением, требующим постоянного внимания и быстрой реакции на внезапно возникающие ситуации и стимулы в условиях повышенного риска. При наличии в ЭЭГ признаков снижения порога судорожной готовности в виде нерегулярных, невысокой амплитуды острых феноменов, высокоамплитудного заостренного α- и β-ритма, вспышек высокоамплитудных медленных волн исследуемый нуждается в более углубленном психиатрическом и неврологическом обследовании для принятия решения. Особое значение здесь имеет оценка риска эпилепсии по системе «Эпидавр». Обнаружение 2-й и выше степени риска эпилепсии служит достаточным основанием для профессионального отсева. Определенное значение имеет также профессиональный статус исследуемого. Если речь идет о первичном обследовании при приеме на работу или обучение, решение об отсеве принимается более жестко. В случае уже работающего профессионала, когда отсутствуют жалобы и явные клинические проявления патологии, требуются более углубленные исследования ЭЭГ, включающие запись с депривацией сна на фоне суточного голодания, запись ночного сна с не менее чем восемью отведениями собственно ЭЭГ. В случае обнаружения вспышек медленной активности в бодрствовании необходимо исследование с предъявлением во время вспышек звуковых щелчков с регистрацией реакции пациента по методике, описанной выше в приложении к дифференциации клинических и субклинических абсансов. Обнаружение дефицита внимания при этой пробе является поводом для отсева, если же проба выполняется правильно во всех случаях, испытуемый может продолжать работу в данной профессиональной области, оставаясь под наблюдением.
Если речь идет о неэпилептиформных проявлениях, то трактовка зависит от степени их выраженности. Грубые и умеренные изменения и постоянные локальные изменения ЭЭГ любой степени тяжести являются проявлением патологии, и исследуемый нуждается в полном неврологическом обследовании и соответствующем лечении. Легкие диффузные изменения не обязательно свидетельствуют о наличии актуальных органических нарушений и сами по себе не могут являться поводом для профессионального отсева, как и варианты нормы, такие как низкоамплитудная ЭЭГ и быстрый а-вариант.
При решении вопросов об инвалидности, возникшей в связи с профессиональной деятельностью (травма головы, известные вредные факторы), следует учитывать уже упоминавшуюся закономерность, что изменения в ЭЭГ в основном являются проявлением актуального развивающегося патологического процесса и в резидуальных состояниях даже при тяжелом органическом дефиците могут практически отсутствовать. В связи с этим следует твердо помнить, что отсутствие патологических изменений в ЭЭГ не является доказательством интактности центральной нервной системы. С другой стороны, даже легкие изменения ЭЭГ или записи, пограничные между нормой и патологией, в контексте клинической картины, включая субъективные жалобы больных, могут быть свидетельством наличия церебральной патологии, если известен причинный фактор возникновения инвалидизирующего состояния. Так, после черепно-мозговой травмы при отсутствии четкой «органической» неврологической симптоматики, нередко возникают синдромы «функционального» характера, проявляющиеся головными болями, астенией, эмоциональными расстройствами, вестибулярными нарушениями, сонливостью днем и бессонницей по ночам. Весь этот комплекс симптомов говорит о дисфункции неспецифических срединных структур мозга, поэтому проявления дисфункции этих же структур в ЭЭГ, такие как низкоамплитудная активность, диффузные тэта-волны до 50-60 мкВ амплитудой, группы или вспышки билатерально-синхронных волн при гипервентиляции, которые могут встречаться и в норме, в этом контексте подтверждают диагноз посттравматических нарушений, что электроэнцефалографист должен отметить в заключении. Как видно, те негрубые дисфункциональные проявления в ЭЭГ, которые при решении вопросов профессиональной пригодности при мотивации у обследуемого к данной работе и отсутствии клинической симптоматики не могут служить поводом для профессионального отвода, в этой ситуации имеют противоположный смысл, мотивируемый всем комплексом факторов, влияющих на исход экспертизы.
В судебно-медицинской экспертизе вопросы диагностики эпилепсии возникают в оценке мотивов совершенного поступка или наличия сознания в момент аварии у лица, ответственного за возникновение соответствующей ситуации. Тактика проведения экспертизы здесь совпадает с описанной в приложении к профессиональному отбору. Необходимо полное обследование на выявление заведомой эпилептиформной активности типа паттерна эпилептического припадка и эпилептического разряда, оценка реактивности во время этих паттернов и вспышек медленной активности в ЭЭГ. Эту пробу целесообразно проводить и при отсутствии патологических изменений в ЭЭГ, а при наличии вспышек аномальной активности предъявлять стимулы вне и во время этих вспышек с равной вероятностью. Пропуск реакций на фоне нормальной ЭЭГ будет подозрителен на его преднамеренность, с другой стороны, нормальные реакции в нормальных участках ЭЭГ и пропуски во время вспышек даже неэпилептиформной активности будут сильным свидетельством патологических нарушений слежения и сознания, поскольку исследуемый, естественно, не может знать о том, какой характер имеет ЭЭГ в момент предъявления стимула. Дифференциацию симулируемых или психогенных припадков от эпилептических, если они, по имеющимся сведениям, часты и легко вызываются, можно осуществить уже описанной пробой с внутривенным введением физиологического раствора под видом конвульсанта, а затем из другого шприца — якобы противосудорожного препарата с одновременной записью ЭЭГ.
В любом случае показана оценка риска эпилепсии с помощью индексов эпи-лептичности. Напомним, что благодаря стопроцентной специфичности системы «Эпидавр» 3 степень риска по этой оценке эквивалентна достоверному диагнозу эпилепсии. Следует иметь в виду, что ряд признаков в этой системе зависит от информации, сообщаемой исследуемым, что, естественно, не исключает определенных девиаций индексов в зависимости от мотивации исследуемого. При профессиональном отборе исследуемый замалчивает или диссимулирует факторы (например наследственности, раннего анамнеза, оценки самочувствия), при судебно-медицинском исследовании могут наблюдаться обратные тенденции. Соответственно в первом случае клинический индекс риска оказывается заниженным, и поэтому поводом к отсеву может служить 2 или даже 1 степень риска эпилепсии, если она определяется положительным электроэнцефалографическим индексом риска. Во втором случае возможно получение ложно завышенного клинического индекса риска, однако при отсутствии достаточно выраженных изменений ЭЭГ система не даст положительного диагноза эпилепсии, что исключает ложную диагностику за счет симуляции. И, наконец, нужно твердо помнить, что в связи с нестопроцентной чувствительностью системы недостижение третьей степени риска не обязательно исключает эпилепсию, хотя делает ее менее вероятной.
Читайте также
- Эпилептология
- Эпилептический очаг
- Типы эпилептических припадков
- Эпилептиформная активность на ЭЭГ
- Эпилептическая активность на ЭЭГ
- Изменения ЭЭГ при эпилепсии
Footnotes
- Карлов В.А. Эпилепсия. – М.: МИА, 2002.
- Карлов В.А. Эпилепсия у детей и взрослых женщин и мужчин. – М.: Медицина, 2010. – 720 с
- Гусев Е.И., Авакян Г.Н., Никифоров А.С. Эпилепсия и ее лечение. Руководство. – 2-е издание исправленное и дополненное. – М.: ГЭОТАР-Медиа, 2016. – 310 с.
- Окуджава В.М. Основные нейрофизиологические механизмы эпилептической активности. – Тбилиси: Наука, 1969. – 302 с.
- Бехтерева Н.П., Камбарова Д.К., Поздеев В.К. Устойчивое патологическое состояние при болезнях мозга. – Л., 1978. – 240 с.
- Крыжановский Г.Н. Детерминантные структуры в патологии нервной системы: Генераторные механизмы нейропатологических синдромов. – М.: Медицина, 1980. – 359 с.
- Calcagnotto М.Е., Paredes М.Е, Tihan Т, Barbara N.M., Baraban C.S. Dysfunction of Synaptic Inhibition in Epilepsy Associated with Focal Cortical Dysplasia//J. Neu-rosci. 2005.25(42): 9649-9657.
- Wasser St., Kasper J.M. Die BedeutungdesEEGfurdieverschidenen Klassifika-tionen der Epilepsien: Ergebnisse bei 856 kindlichen Epileptikern / Zbl. Neurochir., 1984, Bd. 45, s. 318-325.
- Авакян Г.Н., Блинов Д.В., Лебедева А.В., Бурд С.Г., Авакян Г.Г. Классификация эпилепсии Международной Противоэпилептической Лиги: пересмотр и обновление 2017 года. Эпилепсия и пароксизмальные состояния. 2017; 9 (1): 6-25.
- Noachtar S. Der Klicker-Test: eine einfache Metode zur Prufung und Dokumen-tation der Bewustseinlage im EEG / EEG-Lab., 1993, Bd. 15, s. 41—46.
- Eeg-Olofsson O. The development of the electroencephalogram in normal children and adolescents from the age of 1 through 21 years / Acta, pediat. scand. Suppl. 1970, v. 208, p. 1-47.