Микроэлектрод – это миниатюрный электрический проводник, по которому электрический ток поступает в какую-либо среду (или регистрирующий прибор) или уходит из нее. Микроэлектрод находится в непосредственном контакте с поверхностью биологической ткани. Микроэлектроды чаще всего изготавливаются из металла или представляют собой стеклянную микропипетку, внутри которой находится проводящий раствор или филамент. Кроме того, основой “solid-state” микроэлектродов может служить непроводящий материал (кремний, полиамид), внутри которого расположены токопроводящие дорожки (leads), заканчивающиеся непосредственно токосъемными контактами (sites).
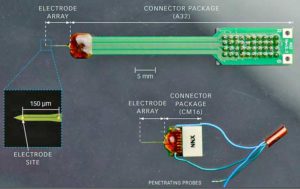
Многоканальный массив микроэлектродов на сверхпрочной кремниевой основе. Регистрация LFP, MUA и активности отдельных нейронов.
В электрофизиологии микроэлектроды используются для регистрации биопотенциалов с возбудимых клеток (нервных, мышечных), либо для электрической стимуляции этих клеток. В клинической и экспериментальной практике примером применения таких электродов (например, при эпилепсии) является интракраниальная ЭЭГ (iEEG), которая требует имплантации электродов непосредственно в мозг. Также, микроэлектроды представляют высокий потенциал в области разработки нейрокомпьютерных интерфейсов для управления бионическими протезами.
Микроэлектроды делятся на два основных типа: внеклеточные (экстрацеллюлярные) и внутриклеточные (шарп-электроды).
История
Идея применения сигналов, полученных с помощью электродов непосредственно от нервной системы человека, для различных целей интересовала ученых достаточно давно. Это связано с тем, что по сравнению с уже ставшими традиционными методами регистрации электрических сигналов на поверхности кожи (ЭЭГ, ЭМГ, ЭКГ и т. п.), объем полученной таким образом информации о различных системах организма достаточно большой (если не исчерпывающий), кроме того, эта информация качественно другого уровня.
Впервые использование металлических микроэлектродов упоминается в статьях американского исследователя Р. Лоренте де Но1, а в СССР — И. С. Бериташвили и сотр., А. Б. Коган и др. Также одна из ранних работ, связанная с проведением микроэлектродных исследований, принадлежит G. Ling и R.W. Gerard, применивших в 1949 г. микроэлектроды для измерения потенциала покоя мышцы лягушки2.
Расцвет микроэлектродных исследований клеток возбудимых тканей наступил после работ W.L. Nastuk и A.L. Hodgkin, зарегистрировавших потенциал действия3, и работ P. Fatt и B. Katz, использовавших микроэлектроды не только для регистрации биоэлектрических потенциалов, но и для электрической внутриклеточной поляризации мембран мышечных клеток4. Еще один вариант использования микроэлектродов был предложен W.L. Nastuk, который апплицировал ацетилхолин на мембрану клетки через микроэлектрод5.
В 1990-е годы интенсивное развитие технологий микрообработки материалов (объемная микрообработка, кремниевая поверхностная микрообработка, LIGA и SIGA-технологии, MEMS-технологии) привело к созданию целого класса имплантируемых устройств – микроэлектродных массивов (МЭМ), английское название – microelectrode arrays или matrix. Подобные устройства предназначены для долгосрочной имплантации в нервную систему человека для создания надежного и безопасного электрического соединения с большим количеством нервных волокон. МЭМ позволяют осуществить не только запись электрических сигналов с отдельных нервных волокон (как сенсорных, так и двигательных), но и их стимуляцию электрическими импульсами, что позволяет управлять сокращением отдельных мышц и создавать искусственные ощущения.
Устройство и типы микроэлектродов
К материалам, из которых изготавливаются имплантируемые микроэлектроды, предъявляются достаточно жесткие требования. Электроды должны быть устойчивы к внутренней среде организма, достаточно легкими, нетоксичными по отношению к окружающим клеткам, не должны со временем разрушаться и вызывать разрушение окружающих тканей. Проводящие материалы должны иметь высокую коррозионную стойкость (особенно при протекании стимулирующих токов), низкий потенциал поляризации. Имплантируемые микроэлектроды не должны иметь острых краев и быть ломкими.
Стеклянный микроэлектрод (микропипетка) — тонкая стеклянная пипетка, заполненная электролитом (солевым раствором), который отводит ток от биологической поверхности и передает на металлический проводник. Для изготовления применяется боросиликатное стекло, из которого с помощью пуллера или микрокузницы непосредственно в лаборатории выплавляют готовую микропипетку. Диаметр кончика стеклянного микроэлектрода около 0,5 мкм, иногда — менее 0,1 мкм.
Недостатком стеклянных микроэлектродов является большая хрупкость, а также высокое электрическое сопротивление (более 10 MΩ).
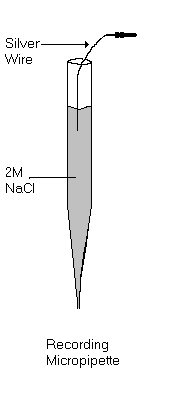
Заполнена электролитом (солевым раствором), который проводит ток от биологической поверхности и передает на металлический проводник (серебро).
Металлические электроды изолированы стеклом, кварцем или иным диэлектриком, обнаженным остается только регистрирующий сайт (наконечник). Тонкая часть электрода, погружаемая в ткань называется шанк (shank). В качестве проводящего материала чаще всего используют платину, иридий, платино-иридиевые сплавы, оксид иридия, золото. Менее предпочтительны, но более доступны нержавеющая сталь, вольфрам. Вольфрамовые электроды обеспечивают стабильную запись, однако имеет место высокая зашумленность низких частот.
Металлические микроэлектроды отличаются низким электрическим сопротивлением от ∼100 kΩ до ∼1 MΩ. Однако из-за того, что диаметр их кончика не может быть сделан меньше нескольких микрометров, такие электроды используют только для внеклеточного отведения.
Разновидностью металлических электродов являются внутриклеточные sharp-электроды, которые вводятся непосредственно в клетку. Они отличаются более тонкими наконечниками и сопротивлением, как правило, более 1 MΩ.
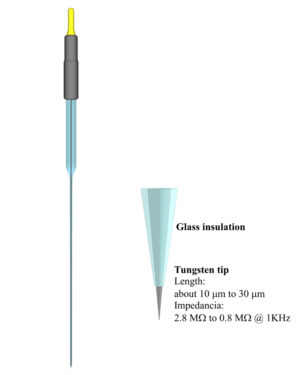
Внешне изолирован стеклом.
Биполярный присасывающий электрод (англ. bipolar suction electrode). При создании отрицательного давления во внутренней полости всасывающего электрода через небольшое боковое отверстие происходит присасывание ткани, подлежащей регистрации, или стимуляции, что происходит непосредственно на конце всасывающего электрода (либо через короткую стеклянную капиллярную пипетку, одноразовый наконечник пипетки, либо через короткую отрезок трубки). Внутренняя полость содержит серебряную проволоку, соединенную с гнездом на задней стороне электрода. Снаружи полости находится короткий отрезок проволоки, который может быть использован в качестве электрода сравнения, или гранула серебра\хлорида серебра с проволочным выводом может быть припаяна к опорному проводу всасывающего электрода для завершения схемы.
Преимущества биполярного электрода:
- он биполярный;
- с включением заземляющего экрана или без;
- простой соединитель с обычными усилителями;
- большой внутренний объем;
- может использоваться со стеклянными капиллярами, кончиками одноразовых пипеток или трубкой малого диаметра;
- поддерживает стеклянные капилляры со внешним диаметром между 1,2 и 1,5 мм.

Карбоновые микроэлектроды (англ. сarbon fiber electrode, CF) содержат сверхтонкое углеродное волокно. Короткие (25-100 мкм) CF-электроды подходят для амперометрических и вольтамперометрических измерений электрической активности нервных клеток in vivo. Также могут использоваться для обнаружения окисляемых соединений (катехоламинов, индоламинов, Fe (II) и др.)
Преимуществом CF в сравнении с вольфрамовыми микроэлектродами является то, что они имеют достаточно низкое отношение сигнал/шум и проще в изготовлении.
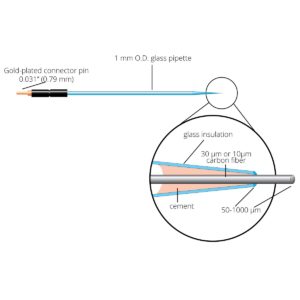
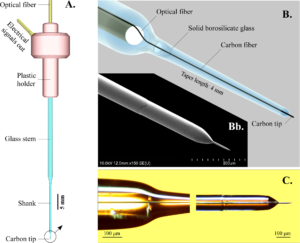
Карбоновые микроволокна (9 мкм) расположены внутри боро-силикатной пипетки. Источник.
Массивы микроэлектродов
Массивы микроэлектродов, микроэлектродные матрицы (англ. microelectrode array, multielectrode arrays, MEA) – представляют собой устройства, которые содержат несколько (от десятков до тысяч) микроэлектродов, через которые получают или доставляют нейронные сигналы , по существу служащие в качестве нейронных интерфейсов, которые соединяют нейроны с электронными устройствами.
Существует два основных класса МЕА: имплантируемые МЕА, используемые in vivo , и не имплантируемые МЕА, используемые in vitro.
Микроэлектроды в массиве для записей in vivo могут иметь линейную или двухмерную и трехмерную конфигурации. В зависимости от материала стержня электрода к наиболее распространенным имплантируемым MEA относятся:
Массивы микроэлектродов из металлической проволоки (англ. microwire array, MWA)6 и металлические микроэлектродные массивы (англ. metal-based microelectrode/microprobe array).7 В качестве проводящего материала для микропроводного и металлического массива чаще всего используют платину, иридий, платино-иридиевые сплавы, никель-хромовые сплавы, реже применяется нержавеющая сталь и вольфрам.8 A. Проволока из нержавеющей стали; B. Полиэтиленгликоль;, C. Эпоксидная смола; D. Коннектор Omnetics. a) трехмерное изображение (без масштабирования); b) типовая схема устройства
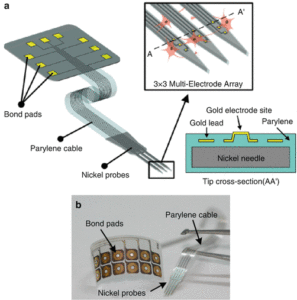
Микроэлектродные матрицы на основе кремния (англ. silicone-based microelectrode/microprobe array). Существует два основных типа структуры кремниевого микроэлектрода: вертикально ориентированная (массивы типа Юта)9и горизонтально ориентированная (массивы типа Мичиган).1011 Мичиганские массивы по всей поверхности микроэлектрода могут иметь от 4 до 256 токоприемных сайта (иридий, платина или золото), что позволяют получать сигналы по всей длине хвостовика. В отличие от Мичиганских массивов, массивы типа Юта регистрируют сигналы только от кончиков каждого электрода, изготовленного из платины, титана, вольфрама или распыленного оксида иридия (SIROF), что ограничивает объем информации, который можно получить за один раз.


Гибкие микроэлектродные матрицы на основе полимера (англ. flexible polymer-based microelectrode/microprobe arrays).12 Благодаря своей гибкости, микроэлектроды на основе полимеров с хорошей биосовместимостью подходят для длительной имплантации в мозг. Преимущество этих мягких материалов состоит в том, что их формы могут деформироваться при микродвижении нервной ткани, что помогает избежать ее повреждения. Для основы этих микроэлектродов используют полимид (чаще всего сочетают с кремнием, для повышения жесткости)13, парилен, бензоциклобутен и полиакриламид или SU-8, а для токоприемныйх сайтов используется иридий, платина, реже золото.

К типам MEA для регистрации биопотенциалов in vitro относят планарные микроэлектродные массивы (англ. planar microelectrode array, pMEA) и трёхмерный массив с выступающими микроэлектродами в форме наконечника (англ. three dementional tip-shaped protruding multielectrodes arrays, 3D MEA). Электроды данных матриц обычно состоят из оксида индия и олова или титана и имеют диаметр от 10 до 30 мкм. Эти массивы обычно используются для одноклеточных культур или острых срезов мозга.1415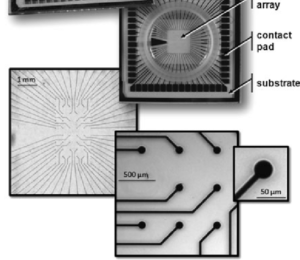

Читайте также
Footnotes
Taketani M, Baudry M. Advances in Network Electrophysiology Using Multi-electrode Arrays, chapter 4. New York: Springer Press, 2006