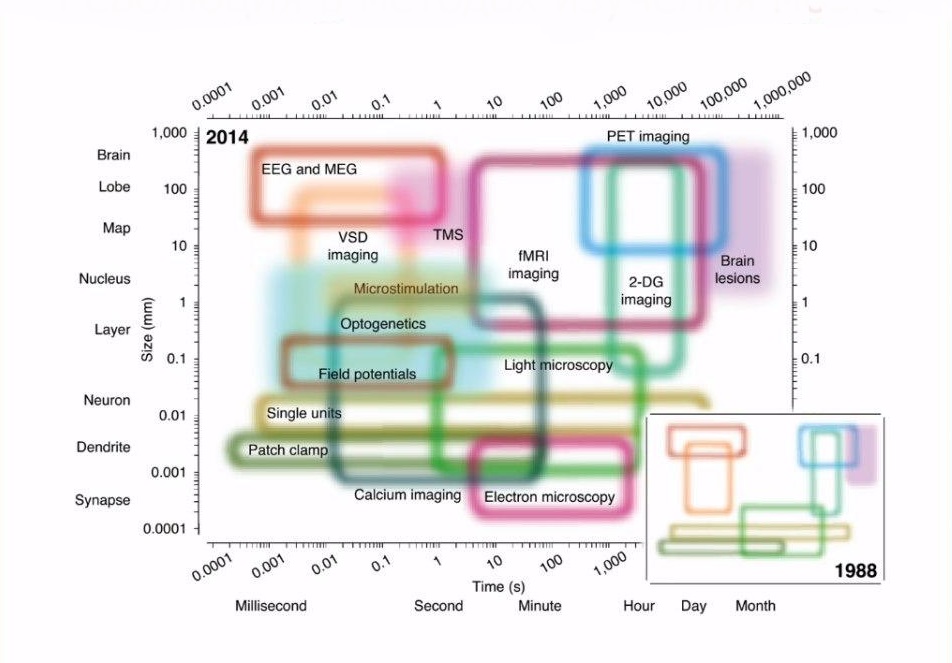
Методы показаны в виде областей в рамках на двумерной плоскости, определяемой различными временными (ось x) и пространственными (ось y) масштабами. Не закрашенные области представляют собой методы измерения, а закрашенные - методы стимуляции. Сокращения: EEG (электроэнцефалография), fMRI (функциональная магнитно-резонансная томография) MEG (магнитоэнцефалография), PET (позитронно-эмиссионная томография), TMS (транскраниальная магнитная стимуляция), 2-DG (2-дезокси- d-глюкоза), VSD (краситель, чувствительный к напряжению)
Современные методы исследования головного мозга основываются на морфофункциональных особенностях нервных клеток и их взаимодействии. Исходя из этого, в зависимости от того на что будет направлен метод их можно разделить на электрофизиологические, методы регистрирующие биопотенциалы мозга; оптические методы, использующие микроскопию, либо отслеживающие метаболические процессы, изменяющиеся в зависимости от активности мозга; методы, позволяющие воздействовать непосредственно на сам мозг, например, используя стимуляцию или вживляя в нейроны новые типы рецепторов.
Все эти методы также можно распределить относительно пространственного и временного масштаба. В пространственном масштабе рассматривается работа мозга начиная от самых мелких его структур, например, ионных каналов, до работы целого мозга. Под временным масштабом понимается то, какой промежуток времени, от миллисекунд до месяцев, метод позволяет регистрировать.
Современные методы исследования головного мозга
Электофизиологические методы регистрации биопотенциалов головного мозга
Электроэнцефалография
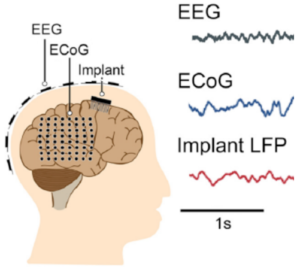
Электроэнцефалография (ЭЭГ) – неинвазивный метод исследования функционального состояния головного мозга путём регистрации его биоэлектрической активности.
➥ Основаная статья: Электроэнцефалография
Достоинства:
- Чувствительность;
- Высокое временное разрешение;
- Высокая проработанность метода.
Недостатки:
- Низкое пространственное разрешение;
- Уязвим для шума и артефактов.
Таким образом, ЭЭГ хорошо подходит для исследования вопросов о скорости нейронной активности и хуже для исследования вопросов о местоположении такой активности.
Электрокортикография
➥ Основная статья: Электрокортикография
Электрокортикография (ЭКоГ) – это инвазивный метод регистрации биопотенциалов нейронов, с помощью суперкортикально (эпидурально или субдурально), интракортикально или субкортикально расположенных электродов.
Достоинства:
- Гибкое размещение регистрирующих и стимулирующих электродов;
- Может быть выполнена на любом этапе: до, во время и после операции;
- Позволяет проводить прямую электростимуляцию головного мозга, выявляя критические участки коры, которых следует избегать во время операции;
- Высокое временное и пространственное разрешение;
- Отношение сигнал/шум лучше из-за более близкого расположения к нейронной активности.
Недостатки:
- Ограниченное время выборки – пароксизмы (иктальные события) могут не записываться в течение периода записи ЭКоГ;
- Ограниченное поля обзора – размещение электрода ограничено областью обнаженной коры и временем операции, возможны ошибки выборки;
- Запись зависит от влияния анестетиков, наркотических анальгетиков и самой операции.
Регистрация потенциалов локального поля
➥ Основная статья: Потенциал локального поля
Потенциалы локального поля (англ. local field potentials, LFP) – временные ритмические сигналы, возникающие в нервной ткани за счет суммации и синхронизации активности отдельных нейронов. Они генерируются за счет дисбаланса концентрации ионов вне клеток в результате электрической активности самих клеток.
Достоинства:
- Возможность регистрации активности в определенной области;
- Высокое временное разрешение;
- Возможность применения метода in vitro;
Недостатки:
- Низкое пространственное разрешение в сравнении с MUR и SUR.
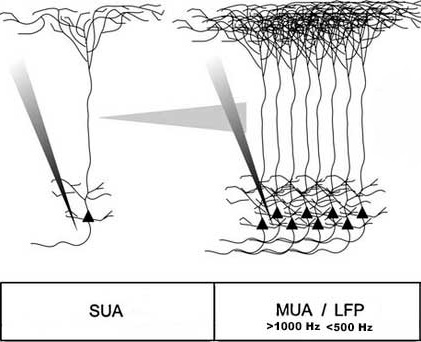
Регистрация мультиюнитной активности (multiunit recording, MUR)
Метод регистрации биопотенциалов мозга, основанный на использовании электродов с большой площадью контакта, что позволяет наблюдать за целыми популяциями нейронов. Используется при невозможности регистрации активности отдельных нейронов или для исследования отдельных нейронных ансамблей. Может проводится как in vivo, так и in vitro.
Достоинства:
- Меньшая сложность исполнения по сравнению с SUR;
- Возможность локализации спайка;
- Высокое временное разрешение;
- Возможность определения количества прилежащих клеток;
- Локализация нейрональной активности.
Недостатки:
- Низкое пространственное разрешениепо сравнению с SUR;
- Большая степень травмирования по сравнению с SUR.
Регистрация активности одиночных нейронов (singleunit recording, SUR)
➥ Основная статья: Активность одиночного нейрона
Метод исследования, основанный на регистрации биопотенциалов отдельного нейрона системой микроэлектродов. Может проводится как in vivo, так и in vitro. Нашел широкое применение в анализе когнитивных способностей, картографировании коры головного мозга и в технологиях интерфейса мозг-компьютер.
Достоинства:
- Высокое пространственное разрешение;
- Высокое временное разрешение;
- Низкая степень травмирования за счет малых размеров;
- Широкий потенциал для практического применения.
Недостатки:
- Высокая сложность исполнения;
- Дороговизна оборудования.
Patch-clamp, метод локальной фиксации потенциала
➥ Основная статья: Patch clamp метод
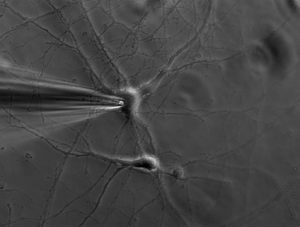
Метод изучения свойств ионных каналов, основанный на изоляции фрагмента клеточной мембраны с помощью микропипетки. Позволяет контролировать разность потенциалов между сторонами мембраны и помещать ее в различные среды.
В электрофизиологии широкое распространение получил метод «Planar patch-clamp» – в отличие от классического метода исследования, в данном случае не пипетка позиционируется на отдельной клетке, а клеточная суспензия наносится на микрочип с упорядоченными отверстиями субклеточного диаметра.
Достоинства:
- Очень высокая чувствительность;
- Возможность изучения свойств каналов в широком диапазоне условий;
- Возможность исследования процессов на молекулярном уровне;
- Высокое временное разрешение;
- Высокое пространственное разрешение – производится исследование отдельной клетки.
Недостатки:
- Дороговизна оборудования;
- Трудоемкий и время затратный метод;
- Потребность в мобилизации клеток посредством ферментов-протеаз, что может приводить к модификации ионных каналов.
Магнитоэнцефлография
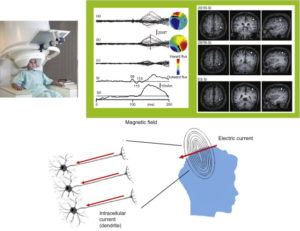
Вверху посередине: магнитные поля после сенсорной стимуляции, где (а) показывает записанные данные, а (b) и (с) отображают остаточные магнитные поля, полученные после фильтрации сигналов соматосенсорной обработки от записанных данных. Вверху справа: исходные местоположения данных MЭГ, наложенных на изображения МРТ.
Магнитоэнцефалография (МЭГ, англ. magnetoencephalography, MEG ) – технология, позволяющая измерять и визуализировать магнитные поля, порождаемые электрической активностью нейронов. Для детекции полей используются высокоточные сверхпроводниковые квантовые интерферометры, или СКВИД-датчики.
Достоинства:
- Чувствительность;
- Высокое временное разрешение – позволяет фиксировать процессы со временем протекания от 0,001 до 1 мс ;
- Возможность клинического применения;
- Высокое пространственное разрешение.
Недостатки:
- Высокая стоимость оборудования;
- Низкая чувствительность по отношению к подкорковым структурам;
- Возможность возникновения помех из-за магнитного поля электронных устройств.
Оптические методы исследования
К методам визуализации можно отнести два подхода в нейрофотонике – методу визуального исследования нейронов – это двухфотонная микроскопия и фиброоптическая микроскопия.
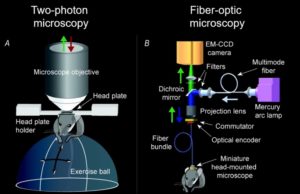
Суть первого заключается во введении методами генной инженерии в клетки биологических сенсоров, реагирующих на изменение концентрации кальция вспышками света. После этого проводится трепанация черепа подопытного животного с заменой части кости стеклом. Животное закрепляется под микроскопом и помещается на подвижный шар, окруженный мониторами, образующими виртуальную реальность.
К отверстию в черепе подводится двухфотонный микроскоп, возбуждающий флуоресценцию только на определенном слое нейронов.
Более инновационным является метод трехфотонной микроскопии. Она позволяет проводить наблюдение через интактный череп на всю глубину коры головного мозга.
Однако «Методом 2018 Года» по мнению журнала Nature Methods1 является визуализация активности нейронов головного мозга свободно передвигающегося животного с помощью мультифотонных минимикроскопов (минископов) на основе фемтосекундных лазеров, подключенных непосредственно к трепанированному черепу. Устройство монтируется на голову животного, а на поверхность мозга устанавливается линза, которая позволяет наблюдать за активностью нейронов в любом слое. Из светодиодов в мозг поступает излучение с определенной длиной волны, тем самым возбуждая светочувствительные клетки с вживленным рецептором. Световой сигнал поступает на чувствительную матрицу и переводится в электрические сигналы.
Сравнительные характеристики современного минископов:
| Характеристики | Современный минископ | Минископ следующего поколения |
|---|---|---|
| Высота | От 22 мм | От 21 мм |
| Масса | 3 грамма | Менее 2 грамм |
| Дата-кабель | Коаксиальный кабель более 5 м длиной | Коаксиальный кабель более 5 м длиной |
| Максимум FPS | 60 | От 120 до 480 |
| Размеры поля видимости | 0.4 мм² | От 1 до 3 мм² |
| Увеличение | От 6х до 7х | От 2х до 3х |
| Средняя рабочая дистанция | 125 мкм | От 0.8 до 2 мм |
| Изменение рабочей дистанции | +/- 125 мкм | +/- 300 мкм |
| Площадь занимаемой на черепе поверхности | 75 мм² | 25 мм² |
| Визуализация и оптогенетика | - | + |
| Коммутатор | + | + |
| Беспроводная технология | + | + |
| Автофокус | - | + |
| Полная ахроматичность | - | + |
| Поддержка множественных фото-детекторов | - | + |
| Возможность структурной подсветки | - | + |

Достоинства:
- Высокое пространственное разрешение;
- Высокое временное разрешение;
- Возможность исследования нейронов в толще коры;
- Возможность исследования слоя толщиной в одну клетку на любой глубине.
Недостатки:
- Инвазивность;
- Потребность в создании генномодифицированных организмов;
- Высокая сложность.
Кальциевый имиджинг
➥ Основная статья: Calcium imaging
Один из методов исследования головного мозга, позволяющих визуально определять момент активации нервной клетки благодаря т.н. кальциевым индикаторам.
Кальциевые индикаторы – молекулы веществ, чувствительных к ионам Са2+ и вызывающих флуоресценцию нейрона при связывании с ними.
Метод получил широкое распространение в связи с развитием оптогенетики. Его сущность состоит в введении в клетку производных EGTA (эгтазиновая кислота), обладающих специфичностью по отношению к ионам кальция и способностью флуоресцировать при связывании с ними.
Также возможно создание генномодифицированных животных, клетки которых вырабатывают белок GFP или его модификации. Данные протеины формируют постоянную флуоресцирующую метку в активных нейронах.
Достоинства:
- Высокое пространственное разрешение;
- Высокое временное разрешение;
- Возможность использования как для отдельных клеток, так и для целого организма.
Недостатки:
- Является вспомогательным методом для оптогенетики;
- Регистрация только одного типа ионов.
Функциональная магнитно-резонансная томография
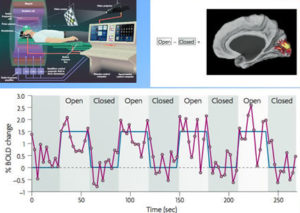
Сначала 30 секунд пациент смотрит на изображение на мониторе затем на 30 секунд закрывает глаза
Один из видов МРТ, проводимый с целью регистрации изменений тока крови в головном мозге. Основан на разнице в магнитных свойствах оксигенированого и дезоксигенированого гемоглобина. Дает возможность установить связь активности нейронов в задействованной области с показателями кровотока в ней. Данный метод позволяет определить активную в момент выполнения того или иного действия зону головного мозга.
Достоинства:
- Неинвазивность;
- Широкая доступность;
- Высокое клиническое значение.
Недостатки:
- Низкое пространственное разрешение;
- Низкое временное разрешение;
- Сильная зависимость результатов от внешних воздействий.
Позитронно-эмиссионная томография
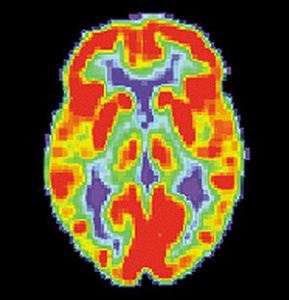
Метод томографии, основанный на регистрации пары гамма-квантов, возникающих при аннигиляции позитронов с электронами. С целью исследования в исследуемый организм вводится радиофармпрепарат, после чего производится облучение бета-радиацией, в результате чего происходит распад радионуклидов. Последующая аннигиляция образовавшихся позитронов порождает два гамма-кванта с одинаковой энергией, разлетающихся в противоположные стороны по одной прямой. Детекторы, расположенные вокруг объекта регистрируют сигналы, а последующая компьютерная обработка полученных данных позволяет сформировать трехмерную модель распределения радионуклидов в объекте.
Достоинства:
- Неинвазивность;
- Наглядность;
- Высокое пространственное и временное разрешение;
- Высокая скорость выполнения.
Недостатки:
- Использование радиоактивных веществ;
Низкая продолжительность исследования в связи с распадом радиопрепаратов.
Визуализация с использованием 2-дезокси-D-глюкозы
Данный метод исследования основан на введении в организм молекул 2-дезоксиглюкозы, меченных тритием или углеродом-14, что позволяет регистрировать распределение глюкозы в организме методом радиографии. Также используется в качестве визуализирующего агента в позитронно-эмиссионной томографии.
Достоинства:
- Высокое пространственное и временное разрешение;
Недостатки:
- Является вспомогательным методом для позитронно-эмиссионной томографии;
- Использование радиоактивных веществ.
VSD имиджинг
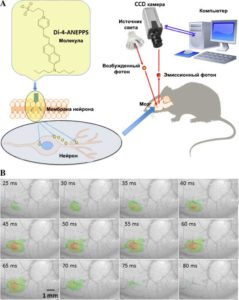
A - Молекулы красителя локализуются в мембранах с их гидрофобными хвостами и оптически отображают мембранные потенциалы. B - VSD оптические изображения, показывающие изменения флуоресценции после стимуляции усов мыши. Начало стимула было в на первом кадре, время после начала стимула указано в левом нижнем углу каждого изображения.
VSD (Voltage-sensitive dyes) или потенциометрическое окрашивание – метод исследования мозговой активности, основанный на введении красителей, изменяющих свой цвет под действием электрического тока. Данный метод позволяет определить место возникновения потенциала действия, его скорость и направление распространения.
Достоинства:
- Широта охвата – данный метод позволяет наблюдать за активацией целых популяций нейронов;
- Обратимость – возможность удаления красителей;
- Возможность регистрации пути прохождения сигнала.
Недостатки:
- Лабильность красителей под действием ряда препаратов;
- Неспособность проникать через клетки соединительной ткани (частично преодолена современными красителями);
- Существует вероятность негативного влияния на клетки;
- Относительно невысокое разрешение получаемых результатов.
Методы воздействия на головной мозг
Транскраниальная магнитная стимуляция
➥ Основная статья: Транскраниальная магнитная стимуляция
Метод основан на стимуляции нейронов коры головного мозга короткими магнитными импульсами, что вызывает возбуждение ингибиторных нейронов. Регистрация результатов осуществляется электромиографически благодаря сокращению соответствующих периферических мышц согласно их топографическому представительству в коре.
Достоинства:
- Неинвазивность;
- Возможность применения в клинической практике.
Недостатки:
- Чувствительность к изменениям магнитного поля;
- Зависимость результатов воздействия и от выраженности ингибиторной активности коры, и от интенсивности стимуляции;
- Неоднозначность результатов клинических исследований.
Хемогенетика
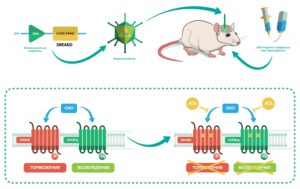
Схематический обзор того, как различные виды DREADD (hM3Dq и hM4Di) могут быть использованы для активации, а также ингибирования групп нейронов с использованием CNO. Также показано ингибирующее действие ахетилхолина (ACh) на CNO. ЗФБ - зелёный флуоресцентный белок CNO - клозапин-N-оксид
Суть данного метода исследования заключается во вживлении в отдельные нервные клетки животного новых, ранее не существовавших у него рецепторов, чувствительных к строго определенному соединению, для избирательной активации данных нейронов. Важно отметить, что используемое соединение не должно оказывать физиологического воздействия на прочие клетки.
Данный метод получил название «Создание DREADD-рецепторов», где DREADD – designer receptors exclusively activated by designer drugs – специальные рецепторы, избирательно чувствительные к созданным препаратам. С помощью их селективной экспресии можно направленно изменять активность разных типов клеток и популяций нейронов в мозге.
Достоинства:
- Отсутствие побочных воздействий используемых препаратов;
- Избирательность действия;
- Неинвазивность.
Недостатки:
- Потребность в создании новых препаратов для проведения исследований;
- Узкий спектр возможного применения для созданных препаратов;
- Потребность в использовании методов генной инженерии.
Оптогенетика
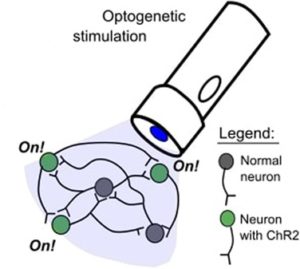
Синий свет избирательно активирует нейроны с канальным родопсином-2 (ChR2).
Суть заключается в создании трансгенного организма, в мембранах нейронов которого находятся светочувствительные рецепторы, влияющие на открытие или закрытие ионных каналов, тем самым вызывая процессы возбуждения или торможения. Возможна широкая вариация свойств рецепторов – от локализации в конкретных клетках и условий синтеза белка до восприимчивости к определенной длине волны.
Для неинвазивного вмешательства возможно применение конструктов с красным смещением. Это достигается путем применения света с длиной волны, обеспечивающей его прохождение через ткани – обычно 630-760 нм.
Достоинства:
- Точность – возможна активация отдельных нейронов;
- Высокое разрешение;
- Широкий диапазон воздействий.
Недостатки:
- Высокая сложность метода;
- Инвазивность.
Микростимуляция
Микростимуляция – инвазивный метод, основанный на введении в кору головного мозга микроэлектродов и стимуляции отдельных ее клеток или участков.
Достоинства:
- Высокая точность метода;
- Наглядность;
- Возможность клинического применения;
- Возможность прямого изучения функций отдельных клеток или участков.
Недостатки:
- Инвазивность;
- Высокая сложность исполнения.
Математическое моделирование с использованием нейросетей

Данный метод исследования головного мозга основан на построении карт месторасположения нейронов и путей прохождения сигнала при определенных видах деятельности и выделении из них характерных паттернов, что позволяет прогнозировать поведение и намерения. Его предполагается использовать для взаимодействия с людьми, потерявшими способность двигаться.
Сочетание методов минископии и обработки данных нейронными сетями позволяет получать карты активности нейронов головного мозга.
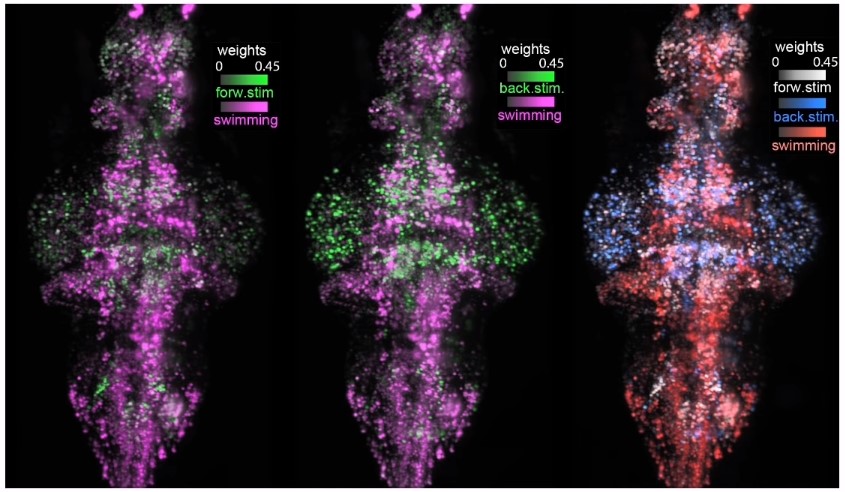
На иллюстрации изображен мозг рыбы-зебры, где выделены все нейроны, участвующие в движении вперед (зеленый цвет на крайнем левом изображении или белый цвет на крайнем правом), движении назад (зеленый цвет на центральном изображении или синий на крайнем правом) и непосредственно плавании (розовый или красный цвета).
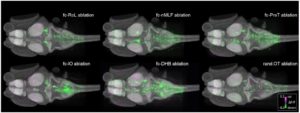
На следующей иллюстрации изображено сочетание методов оптогенетики с внешним воздействием. Суммарно это позволяет увидеть сеть всех нейронов, отвечающих за реакцию на раздражитель. Суть работы, из которой взята иллюстрация, заключалась в наблюдении за этой сетью с последующим удалением ее частей для выделения базовой структуры мозга, определяющей активность, возникающую в ответу на внешний раздражитель.2
Развиваются и методы МРТ, их эволюция связана с увеличением индукции магнитного поля с 1.5 Тл (наиболее распространенный на данный момент стандарт) до 10.5 или даже 11.5 Тл (экспериментальные установки в США и во Франции, запуск которых запланирован на 2018 и 2022 год соответственно).
Был создан метод, получивший название «Zip-Zap стимуляция», который позволил устанавливать факт бодрствования человека посредством обнаружения осцилляций на высокоплотной ЭЭГ или МЭГ после интракраниальной магнитной стимуляции. Высокая скорость затухания и малая область захвата данных отклонений свидетельствует о нахождении человека в состоянии сна, наркоза или комы. Практически данный метод предполагается использовать для больных, находящихся в пограничном состоянии для заключения об их статусе.
Footnotes
- Method of the Year 2018: Imaging in freely behaving animals. Nat Methods 16, 1 (2019). DOI: 10.1038 s41592-018-0292-8
- Vladimirov, N., Wang, C., Höckendorf, B. et al. Brain-wide circuit interrogation at the cellular level guided by online analysis of neuronal function. Nat Methods 15, 1117–1125 (2018). DOI: 10.1038/s41592-018-0221-x