Предварительная обработка (англ. preprocessing, предобработка) – это процедура преобразования необработанных данных в формат, который больше подходит для дальнейшего анализа и интерпретации. В случае ЭЭГ под предварительной обработкой чаще всего понимают удаление шума (артефактов) из полученных данных, с целью приближения их к истинным нейронным сигналам.
Зачем нужна предварительная обработка?
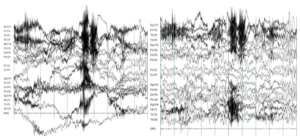
Предварительная обработка данных ЭЭГ необходима по нескольким причинам:
- Во-первых, сигналы, получаемые от кожи головы, не являются точным представлением сигналов, исходящих из мозга, т.к. искажаются данные о локализации процессов;
- Во-вторых, данные ЭЭГ обычно содержат много шума, который может скрывать более слабые сигналы. Артефакты, вызванные миганием глаз или непроизвольной мышечной активностью, могут снизить качество данных и исказить конечное изображение;
- Наконец, необходимо отделить релевантные (значимые) нейронные сигналы от случайной нейронной активности, которая происходит во время записи ЭЭГ.
Чем будет отличаться предварительная обработка в зависимости от предпочитаемого вида анализа
Поскольку в области предварительной обработки ЭЭГ по-прежнему активно ведутся исследования, не существует общепринятой методики предобработки, что означает наличие некоторой свободы в выборе способа преобразования необработанных данных. Ниже приведены некоторые вопросы, которые могут помочь выбрать более подходящие методы предварительной обработки:
- Какие типы артефактов могут присутствовать в данных? Какие из них необходимо удалить, а на какие обратить внимание?
- Например, в зависимости от условий эксперимента, движения глаз и моргание можно считать источником шума, но они также могут выявить важные закономерности;
- Анализ проводится онлайн или офлайн?
- Если предобработка проводится сразу после поступления данных, возможность использовать более требовательные в вычислительном отношении методы может отсутствовать;
- На каких особенностях сигнала необходимо сосредоточиться?
- Например, если необходимо обнаружить потенциалы, связанные с событиями (ERP), потребуется точная временная информация, тогда как для классификации образов движения потребуется точная пространственная информация.
Необходимо иметь в виду, что даже самые передовые методы предобработки не смогут учесть неверные данные – если испытуемые некорректно выполнили задание или не были на нем сосредоточены, или если оборудование работало со сбоями, то лучшим решением будет провести эксперимент заново, а не пытаться спасти данные.
Импорт данных
Большая часть этой статьи будет нацелена на пользователей Python и ссылается на библиотеку MNE 1 для анализа МЭГ и ЭЭГ. Он также доступен для C,2 и у большинства упомянутых моделей существуют эквиваленты в других языках. Так для решения этой задачи с помощью Matlab (или Octave) были созданы такие библиотеки как EEGlab3, Fieldtrip4 и Brainstorm.
FIF
Основным форматом файла, поддерживаемым MNE, является .fif или формат Functional Imaging File.5
EDF / EDF +
➥ Читайте также: EDFbrowser
Второй пример формата файла, который часто используется для данных ЭЭГ – это EDF, европейский формат данных. Файлы .edf содержат читаемый человеком заголовок, за которым следует большой блок двоичных данных, содержащий необработанный сигнал для каждого электрода. Связанный с ним EDF+6 , более поздний формат, является улучшенной версией EDF.
Другие стандартные форматы
FIF и EDF – два наиболее распространенных формата, которые может загружать MNE, но он изначально поддерживал большую коллекцию из более используемых стандартных форматов. Полный список можно найти в документации к файлу MNE,7 и для этого обычно требуются функции вызова, такие как mne.io.read_raw_egi (…) или mne.io.read_raw_eeglab (…).
Другие нестандартные форматы (CSV / .mat)
Существует множество различных форматов файлов для данных ЭЭГ. Например, часто встречаются файлы .mat (для Matlab) или текстовые переменные, разделенные запятыми, (CSV) для хранения сигналов.
Понижение частоты дискретизации
Представим, что у нас есть система ЭЭГ с 64 каналами и частотой дискретизации 600 выборок в секунду (или 600 Гц = герц). Если мы представляем каждую выборку как 32-битное число с плавающей запятой, это (64 * 600 * 32) = 1228800 бит в секунду или 150 кб / сек данных.
Хотя это значение может показаться не очень большим, учтите, что вся эта информация, вероятно, будет передаваться по беспроводному каналу, обрабатываться несколько раз и сохраняться. Это можно было бы изменить, снизив число каналов. Однако данное действие может быть проблематичным, поэтому возникает вопрос: как иначе можно снизить частоту дискретизации?
Здесь и применяется понижение дискретизации – это метод уменьшения количества используемых образцов при сохранении необходимой информации. Он состоит из нескольких частей:
- Строгая понижающая дискретизация – сохранение каждого N-го значения (например, каждую секунду). Технически это именно то, что означает термин «понижающая дискретизация», однако он редко применяется отдельно от других. Подобно изменению размера изображения, этот метод может приводить к появлению артефактов (называемых наложением имен) в результате;
- Децимация – это тоже понижающая дискретизация, но сначала применяется фильтр нижних частот (см. раздел “Фильтрация”), чтобы удалить высокие частоты, вызывающие артефакты. Дополнительные сведения о том, что именно подвергается фильтрации, см. в примечаниях и в конце этого раздела.
Проведение данной процедуры возможно с использованием программного комплекса MNE.
Примечания по понижающей дискретизации
Частоты
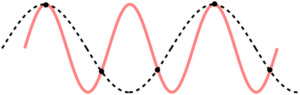
Первое, что необходимо учитывать, когда дело доходит до выборки – теорему выборки Котельникова-Найквиста-Шеннона8. Это правило, касающееся информации, которую вы можете получить из дискретизированного сигнала. Проще говоря: если вы выполняете выборку с частотой R Гц, то любой сигнал с частотой выше половины этой частоты (то есть R / 2 Гц) будет ошибочно принят за более низкую частоту. Этот процесс также известен как алиасинг, при котором более высокая частота накладывается на более низкую. Чтобы понять, почему, посмотрите на точки выборки (черные точки), для высокочастотного сигнала (красная полоса) и низкочастотного (черные черточки). Точки выборки идентичны, поэтому для их дифференциации требуется более высокая частота выборки.
Это важно, когда дело касается сигнала ЭЭГ, который вы обрабатываете. Например, если вы обнаруживаете альфа-волны (до 15 Гц), это означает, что вам потребуется частота дискретизации как минимум 30 Гц, чтобы гарантировано получить сигнал 15 Гц. Точно так же, если рассматривать гамма-волны частотой до 100 Гц, частота дискретизации 200 Гц является минимально допустимой. Более того, в зависимости от применяемой техники предпочтительна даже более высокая частота. Важно выполнять субдискретизацию ровно настолько, насколько необходимо, и иметь в виду, что это может немного изменить результаты.
Нецелые коэффициенты
В разделе «Строгая понижающая дискретизация» говорится о сохранении каждой N-й выборки. Это возможно, если окончательная частота будет составлять ½, ⅓, ¼,… от начальной, но может возникнуть необходимость в более сложных соотношениях между ними. Для любой рациональной дроби (например, ¾) это может быть достигнуто сначала повышением дискретизации на одно число, а затем понижением дискретизации на второе. Например, переход от 200 Гц к 160 Гц (коэффициент 0,8) может быть достигнут повышением дискретизации в 4 раза, а затем понижением дискретизации в 5 раз. Однако существует проблема, поскольку любой алгоритм повышающей дискретизации может только интерполировать новые данные из существующих, что приводит к появлению артефактов в анализе.
Сегментация ЭЭГ
Волны имеют вид импульса, параметрами которого являются форма, амплитуда и длительность. Т. о. последовательность импульсов заключает в себе всю информацию, содержащуюся в ЭЭГ. Совокупность данных параметров, изучаемая при анализе ЭЭГ, называется тонкой структурой ЭЭГ.
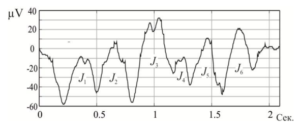
Процедура разделения тонкой структуры на отдельные импульсы (J1, J2, J3…) называется сегментацией ЭЭГ. Эта процедура выполняется для извлечения и проведения подробного анализа информации, содержащейся в сигнале.
В общем смысле задача сегментации ЭЭГ формулируется как задача обнаружения момента изменения свойств процесса, стационарного как до, так и после изменения. Например, на иллюстрации ниже такими моментами будут точки а2 и с2, ограничивающие сегмент J2.
ЭЭГ является нестационарным (т.е. изменяющимся во времени без определенной закономерности) процессом, который может быть разделен на информативные квазистационарные участки, которые будут отражать состояние определенных отделов головного мозга, что необходимо для определения ряда диагностических признаков и правильной постановки диагноза. Определение границ этих участков и является основной задачей сегментирования ЭЭГ.
Кроме того, сегментация ЭЭГ необходима для обоснованного отнесения отдельного импульса к одному из видов биоэлектрической активности согласно его спектральным характеристикам. Разделение непрерывного сигнала ЭЭГ на отдельные импульсы позволяет проводить анализ отдельных сегментов графика, что дает возможность определить точечные характеристики сигнала и установить точную временную локализацию основных феноменов.

Существует ряд методик, на которых основывается процесс сегментации. Основными считаются три группы:
- методы рекуррентных статистик (МРС);
- методы кумулятивных сумм (МКС);
- методы динамических эталонов (МДЭ).
Сущность МРС заключается в вычислении ряда статистических параметров фрагмента ЭЭГ для отнесения его к одному из заранее заданных классов. С ними сходны МКС: основное отличие заключается в используемом математическом аппарате. Данное отличие позволяет не только классифицировать готовые сегменты, но и устанавливать границы сегментов в автоматическом режиме за счет регистрации изменений в ряде статистических величин. Основой такого разделения служат различия этих величин у стационарных и нестационарных процессов (как было сказано ранее, задача сегментации сводится как раз к обнаружению таких моментов). Третья группа методов: МДЭ, они основаны на сравнении наблюдаемого значения отсчета с некоторым эталоном, который определяется путем статистического прогноза. Фактически, эталон для сравнения будет представлять собой ожидаемое среднее значение. Отклонения от него будут служить основанием для обнаружения момента изменения и отнесения фрагмента к тому или иному классу.
Проведение сегментации возможно с использованием программных средств пакета MATLAB (версия 8.2.0.701 (R2013b)) или WinEEG .
Удаление “плохих” каналов и интерполяция
Что такое «плохой» канал?
Иногда данные ЭЭГ (особенно данные высокой плотности) содержат «плохие» каналы, которые не предоставляют точной информации. Важно убрать их на раннем этапе, потому что сохранение этих данных повлияет на дальнейший анализ. Есть несколько причин, по которым канал может быть исключен:
- Канал по какой-то причине не работает;
- Электрод был неправильно установлен или не касался кожи головы;
- Образование солевого мостика в результате растекания электролита (при работе с мокрыми электродами);
- Перенасыщение канала (при работе с мокрыми электродами).
Как определить «плохой» канал
Обнаружить «плохие» каналы возможно еще до того, как закончится сбор данных. Например, если вы знаете, что один из каналов не работает должным образом или если вы заметили, что один из электродов потерял контакт с кожей головы во время эксперимента, вы можете пометить его для исключения из анализа.
Наиболее распространенный способ обнаружения плохих каналов после сбора данных – визуализация необработанных данных. Так, например, вы можете искать каналы, которые либо не имеют сигнала (плоская линия), либо кажутся значительно более зашумленными, чем другие.

Обратите внимание, что решение об удалении канала из-за высокого уровня шума может быть несколько субъективным. Используйте свой опыт, чтобы определить, насколько зашумлен канал. Необходимо принять во внимание, что при помощи метода ICA можно удалить часть шума и не исключать канал. После того, как вы решили, какие каналы удалить, вы можете пометить «плохие» каналы либо с помощью командной строки, либо в интерактивном режиме, щелкнув строку канала или имя канала в окне. Каналы, по которым вы щелкнули, будут помечены как «плохие» после закрытия окна.
Как удалить «плохой» канал из данных
Как только вы определили «плохие» каналы, вы можете исключить их из дальнейшего анализа, выбрав подмножество каналов, которое исключает те, которые помечены как «плохие» с помощью программных методов.
Обратите внимание: если у вас много «плохих» каналов или общее количество каналов изначально невелико, простое удаление плохих каналов приведет к значительной потере информации. В этом случае вы можете восстановить или интерполировать исключенные каналы.
Интерполяция
После выбора «плохих» каналов обычно проводится интерполяция данных на основе данных из «хороших» каналов. Интерполяция – это способ заполнения недостающих данных на основе других доступных данных.
Есть несколько способов интерполировать данные ЭЭГ, но наиболее распространенным методом является интерполяция сферическими сплайнами.
Сплайн – это функция, график которой разбивается на конечное число отрезков, на каждом из которых сплайн совпадает с графиком некоего алгебраического уравнения. Так, например, сплайном иллюстрации 1, будет график на иллюстрации 2.
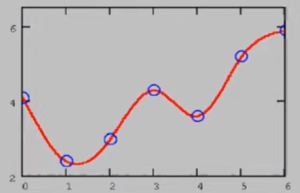
Целью этого метода является упрощенное описание некоего сложного графика через систему более простых уравнений.
Применительно к ЭЭГ, данный метод позволяет восстановить поврежденные или “плохие” фрагменты ЭЭГ и состоит из следующих шагов:
- Проецирование расположения каналов на единичную сферу (представляющую голову);
- Вычисление матрицы, описывающей отношения между «хорошими» и «плохими» электродами;
- Интерполяция данных для неисправных электродов на основе результатов пункта 2.
Фильтрация
➥ Основная статья: ЭЭГ фильтры и методы фильтрации сигнала
При анализе частот цифрового сигнала (звук, ЭЭГ и т.д.), популярной является фильтрация определенных частот, при которой некоторые из них удаляются. Есть несколько типов фильтров:
- Фильтр низких частот: частоты ниже определенного значения сохраняются (они «проходят»), а высокие частоты удаляются;
- Фильтр высоких частот (он же Low-cut): Применяется та же логика, что и выше, но остаются только высокие частоты, а удаляются те, что ниже определенного значения;
- Полосовой фильтр: является объединением предыдущих двух и сохраняет только частоты между нижней и верхней границей. Противоположностью ему является режекторный фильтр, который удаляет все частоты в определенном диапазоне;
- Фильтр-пробка: это особый тип режекторного фильтра, предназначенный для удаления одной определенной частоты. Также можно комбинировать несколько режекторных фильтров, чтобы удалить определенный набор отдельных частот, что полезно, например, для удаления электрического шума.
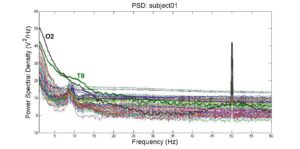
В анализе ЭЭГ они применяются для:
- Устранение электрического шума: обычно электрические цепи, окружающие измерительные приборы, могут вносить шум в диапазоне 50 Гц или 60 Гц (и в кратных им);
На этом изображении (с сайта9 ) отчетливо виден шум частотой 50 Гц от электричества (обратите внимание, что некоторые страны, например США, используют частоту 60 Гц). Для их устранения можно применить режекторный фильтр к необработанному сигналу с MNE, чтобы удалить 50 Гц и его кратные.
- Часто нас интересует только определенный частотный диапазон, например, если вы ищете альфа-волны, нужен только диапазон 7,5 Гц – 12,5 Гц, поэтому может возникнуть потребность в полосовом фильтре между этими значениями, чтобы удалить любой шум за пределами этого диапазона;
- Для удаления очень низкочастотных сигналов может быть добавлена фильтрация высоких частот. Они слишком медленные, чтобы исходить из мозга, и обычно являются признаком долговременного дрейфа (произвольное смещение частоты относительно ее номинального значения) в среде записи, например, из-за плохого контакта электрода с кожей.
Однако при выполнении любой фильтрации следует соблюдать осторожность, чтобы не допустить появления дополнительных погрешностей.
Ремонтаж
➥ Смотрите подробнее: Монтаж отведений ЭЭГ
Что такое отбор референса?
В данных ЭЭГ напряжение для каждого электрода записывается относительно других. Референс, которым может быть один или несколько электродов – это тот электрод, относительно которого будет измеряться напряжение. Это означает, что нейронная активность на контрольном электроде также будет отражаться на всех других электродах, что может изменить сигнал. Это также означает, что выбор референса будет иметь решающее значение в дальнейшей интерпретации данных.
Как отбираются референсы?
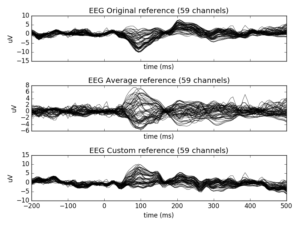
При выборе референса важно, чтобы электрод(ы), который вы выбираете в качестве референсного, как можно меньше влиял на расположение интересующего вас источника сигнала. На практике это означает, что либо референсы расположены далеко от интересующего источника сигнала, либо используется среднее значение нескольких электродов.
Вот некоторые распространенные варианты эталонов:
- Расположенние референсов на сосцевидных отростках (электроды, расположенные за ушами человека). Данный эталон получил распространение благодаря тому, что данные электроды находятся относительно далеко от мозга, но близко к другим электродам. Однако в этом месте все еще присутствует некоторая нейронная активность. Можно использовать либо один из сосцевидных отростков, либо среднее значение сигнала от двух сосцевидных отростков;
- Среднее значение сигнала с двух мочек ушей также часто используется по тем же причинам, что и сосцевидные отростки;
- Cz (центральный электрод) часто выбирают при записи мозговой активности, находящейся далеко от этого места;
- Среднее значение всех электродов (также известное как общее среднее эталонное значение). Такой выбор сравнения снижает влияние любого отдельного неисправного электрода на результаты и является выбором по умолчанию в MNE. Однако использование этого референса имеет смысл только для систем, в которых достаточно много каналов, чтобы общая активность в среднем была равна 0. Если у вас меньше 32 каналов, рассмотрите возможность использования другого референса.
Любая гарнитура для ЭЭГ поставляется с заранее заданным референсом; однако можно использовать иной референс для данных после того, как они были собраны. В MNE вы можете изменить референс с помощью встроенной команды.
Выявление и коррекция артефактов
➥ Читайте также: Артефакты ЭЭГ
Типы артефактов
Артефакты – это сигналы, которые улавливаются системой ЭЭГ, но не являются мозговой активностью. Существует множество различных источников артефактов для ЭЭГ, которые проявляются по-разному. Артефакты ЭЭГ можно условно разделить на биологические и физические.
- Артефакты окружающей среды (физические) возникают из-за вмешательства извне, например, влияние линий электропередач, потеря контакта электродов или движение других людей во время эксперимента. Самый простой способ свести к минимуму влияние этих артефактов (например, экранировать комнату, правильно закрепить электроды). Помехи в линии питания можно устранить, применив режекторный фильтр на 50 или 60 Гц, и, по сути, этот фильтр уже встроен в некоторые гарнитуры. Влияние артефактов окружающей среды также можно несколько уменьшить, если использовать активные электроды (электроды с дополнительным усилителем, с меньшим уровнем шума, внутри);
- Биологические артефакты происходят от самого испытуемого. Некоторые из наиболее распространенных биологических артефактов – это моргание, движение глаз, движение головы, сердцебиение и мышечные артефакты. Эти артефакты можно выявить, если у вас есть доступ к другим биометрическим данным, например, электроокулограммы (ЭОГ), акселерометра для артефактов движения головы и электрокардиограммы (ЭКГ) для артефактов сердцебиения;
- Нейронные сигналы, не имеющие отношения к исследуемому вами явлению, также можно рассматривать как источник артефактов. Например, у уставших участников часто наблюдаются большие спайки альфа-волн; если нет необходимости наблюдать за этим эффектом, вы можете удалить эту активность из данных.
Выявление на основе визуализации
Один из способов найти артефакты – просто посмотреть на данные, поскольку биологические артефакты, как правило, имеют распознаваемые паттерны.
Так, например, на иллюстрации ниже изображен пример набора данных в котором возможно выделить зашумленные сегменты, чтобы удалить их позже.
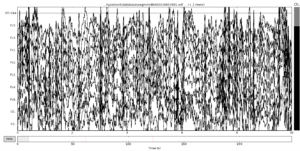
Вы можете нажать клавишу «a», чтобы войти в режим аннотации:

Теперь вы можете отмечать зашумленные сегменты, щелкая левой кнопкой мыши и перетаскивая их. По умолчанию выделенные сегменты будут помечены как «плохие», но при желании вы можете создать другие метки, нажав «Добавить метку».
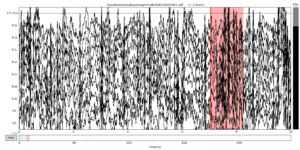
Когда вы объединяете данные в эпохи для дальнейшего анализа, отмеченные сегменты будут исключаться автоматически.
Обратите внимание, что поиск артефактов на основе их визуализации может быть ненадежным, так как он зависит от мнения наблюдателя. Однако есть способы автоматического обнаружения «плохих» сегментов, например, на основе дисперсии сигнала, вероятности того, что в конкретном канале будет виден паттерн активности, или увеличения величины напряжения. MNE обеспечивает поддержку автоматического отклонения эпох на основе размаха амплитуды: каждая эпоха имеет словарь отклонения, который содержит типы каналов и значения пороговой амплитуды.
Предварительная обработка при высокой и низкой плотности
В данном разделе термины “высокая плотность” и “низкая плотность” относятся к количеству электродов, которые регистрируют активность мозга. При ЭЭГ низкой плотности используется 21 электрод (при стандартной международной системе “10-20”), а в ЭЭГ высокой плотности количество электродов доходит до 256.
Системы ЭЭГ высокой плотности дали большой толчок исследованиям, что хорошо с точки зрения стандартизованных исследований, но приводит к сложностям в инновациях в гарнитурах для ЭЭГ низкой плотности и их предварительной обработке. В целом, основные различия в предварительной обработке заключаются в удалении каналов (из-за меньшего количества каналов), использовании маркеров событий (из-за задержки Bluetooth), качестве данных (из-за нестандартных электродов), привязке и морфинге потенциалов, связанных с событием (ПСС, англ. event-related potential — ERP) (из-за нестандартных электродов).
Удаление канала
При использовании гарнитуры ЭЭГ высокой плотности случайный «плохой» канал просто удаляется, поскольку существует достаточно других каналов для компенсации и удаление не оказывает значительного влияния на анализ данных.
Однако в системах ЭЭГ низкой плотности количество каналов ограничено, поэтому отказ от каналов с шумом невозможен. Отсюда важность соответствующего обучения тех, кто настраивает оборудование, чтобы снизить зашумленность.
Использование маркеров событий
Маркеры событий используются для обозначения определенных событий или областей интереса в файлах ЭЭГ по мере их записи, для упрощения анализа ERP. Они очень часто встречаются в ЭЭГ высокой плотности, потому что она передается на компьютер с помощью кабелей. Однако многие системы ЭЭГ с низкой плотностью подключены через Bluetooth, у которого есть задержка, которая варьируется в пределах десятков миллисекунд (Krigolson, 2017 сообщил, что 40 мс +20 мс), поэтому анализ не может использовать маркера событий, как указания на то, какие разделы данных необходимо анализировать.
В качестве альтернативы маркерам событий некоторые протоколы предварительной обработки могут определять наклон изменения сигнала и указывать, что это, вероятно, ERP. Тем не менее, протоколы без маркеров событий еще не разработаны.
Качество данных
Аппараты ЭЭГ высокой плотности часто используются с влажными электродами, которые обеспечивают лучшее качество сигнала, чем сухие. Проблема качества сигнала еще более усложняется ограниченным количеством каналов в ЭЭГ низкой плотности, поскольку плохой канал не может быть просто удален (см. раздел “Удаление канала”).
Криголсон (2017)10 назвал качество сигнала основной проблемой в экспериментах, но также заявил, что достаточное качество можно было бы легко получить, если бы пользователи более внимательно следовали руководствам и приобрели опыт работы с системой Muse.
Референс и форма ERP
В системах ЭЭГ высокой плотности доступно множество каналов, поэтому существует несколько популярных вариантов для сравнения (например, сосцевидные каналы). Однако при использовании ЭЭГ низкой плотности аппаратные средства ограничивают возможности привязки. Обычный компромисс для систем с низкой плотностью – ссылка на канал Fpz.
Следствием этих аппаратных ограничений является то, что форма хорошо изученных ERP может быть различной. Это не обязательно влияет на количественную оценку обнаруженной ERP, поэтому анализ все равно может быть успешным. Это происходит из-за того, что привязка не выполняется для значительного количества более удаленных каналов, поэтому характеристики сигнала, которые будут выделяться, будут другими, что приведет к нестандартной форме ERP.
Коррекция артефактов
Коррекция артефактов предназначена для удаления нейронных сигналов, которые не подходят для анализа. Однако эти методы часто пересекаются с методами, используемыми для выделения различных влияний на измеряемый сигнал (разделение источника), а затем оценки его локализации в головном мозге (локализация источника). Таким образом, мы опишем концептуальные методы, обсудим их использование для исправления артефактов, локализации и разделения источника и продемонстрируем функциональность исправления артефактов.
Основное предположение состоит в том, что если два сигнала статистически независимы, то, даже если они сложены вместе, можно выделить факторы, которые не позволяют их прогнозировать (статистически независимы).1112131415 Это называется разделением источников и выполняется с помощью ICA, PCA, SSP или других методов.
Как только сигналы разделены, их можно локализовать, установив их на фиксированные колеблющиеся диполи (см. раздел “Дипольная подгонка”). Это называется локализацией источника и часто выполняется с помощью дипольной подгонки.
ICA
➥ Основная статья: Метод независимых компонент
ICA – это метод, который разделяет и локализует независимые сигналы, которые были добавлены вместе. Он был создан для решения проблемы коктейльной вечеринки, в которой необходимо изолировать соответствующий разговор от шума других разговоров, скажем, на коктейльной вечеринке.
Для разделения источников ICA обычно считается лучшим, поскольку он не предполагает ортогонального или гауссовского поведения отдельных сигналов, что является необоснованным предположением, от которого зависят другие методы. В любом случае ICA по-прежнему предполагает, что сигналы статичны, а отдельные сигналы статистически независимы, что может не подходить для некоторых нейронных сигналов.
При коррекции артефактов ICA используется для разделения компонентов с целью выявления артефактов от движений глаз или ударов сердца. Они имеют характерную форму и часто могут быть идентифицированы автоматически.
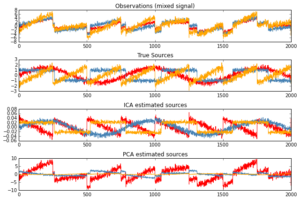
Применительно к ЭЭГ и ЭМГ (электромиография), ICA намного более эффективен, чем его более простой аналог, PCA (анализ главных компонентов), который предполагает, что все сигналы ортогональны, и создает последовательность ортогональных базовых векторов, где каждый вектор будет учитывать как можно больше отклонений.
В результате при использовании PCA первый вектор значительно больше по величине, чем все последующие векторы. Когда отношение сигнал / шум (SNR) низкое, важная информация в этих последующих векторах может быть потеряна.
Существует множество источников, в которых обсуждаются методы ICA и способы их применения с библиотеками с открытым исходным кодом в MATLAB (EEGLAB) и Python (Open Python EEG).
SSP (проекция сигнального пространства)
SSP похож на PCA в том, что он отделяет сигнал от шума на основе ортогональности. Основное используемое допущение состоит в том, что сигналы и шум генерируются в фиксированных и разных положениях и ориентациях, поэтому их вклад линейно независим и демонстрирует стабильную картину поля, даже если они меняются по величине со временем. Затем мы берем матрицу U в качестве ортонормированной основы всех шумовых сигналов (определенных ранее) и определяем ![]() в качестве оператора проекции пространства сигналов, который удаляет любой вклад, параллельный шуму, описанному U. Применяя оператор проекции пространства сигнала к исходному сигналу, мы сохраняем только вклады сигнала, которые перпендикулярны ожидаемому шуму:
в качестве оператора проекции пространства сигналов, который удаляет любой вклад, параллельный шуму, описанному U. Применяя оператор проекции пространства сигнала к исходному сигналу, мы сохраняем только вклады сигнала, которые перпендикулярны ожидаемому шуму: ![]() .
.
Этот метод чрезвычайно эффективен при удалении шума, тем более что матрица U, определяющая ожидаемый шум, может быть очень избирательной. Однако соответствующие сигналы, которые не перпендикулярны шуму, могут быть уменьшены или даже удалены.
При сравнении ICA и SSP было обнаружено, что оба дают схожий SNR, тогда как ICA работает немного лучше. Кроме того, SSP производит меньше шума и меньше сигнала, тогда как ICA переносит шум вперед, но идентифицирует сигналы, не уменьшая их.
Фильтры Максвелла: SSS и tSSS
Фильтры Максвелла основаны на уравнениях Максвелла, описывающих электромагнетизм.
SSS (разделение сигнального пространства) – это метод, эксклюзивный для МЭГ, который разделяет сигнал МЭГ на компоненты, возникающие в черепе, и компоненты, возникающие вне его. Компоненты, смоделированные вне головы, просто удаляются из векторного базиса, а их шумовые составляющие стираются. Это чрезвычайно мощный инструмент, поскольку он не зависит от каких-либо предположений о том, каким должен быть внешний шум, и не требует жертвовать каким-либо сигнальным каналом ради привязки. Тем не менее, системы МЭГ не могут улавливать радиальные сигналы.
tSSS (временное разделение сигнального пространства) похож на SSS, но он использует временную согласованность сигналов внутри черепа, чтобы отличить сигнальное пространство мозга внутри черепа от артефактов, генерируемых между черепом и датчиками. Это помогает удалить мышечные артефакты (например, мигание) и артефакты, вызванные другим мешающим оборудованием, например датчиками ЭЭГ.
Дипольная подгонка
Дипольная подгонка состоит в моделировании поведения мозга как колеблющихся диполей в определенных положениях. Он основан на концепции, согласно которой мозговые волны возникают в результате синхронного возбуждения групп взаимосвязанных нейронов, что можно смоделировать как диполь потенциала напряжения, колеблющийся в определенном положении.16
Эта концепция обоснована, поскольку десятилетиями обсуждалась во многих публикациях. Тем не менее, математический процесс прямой подгонки источников колебательных диполей к сигналу ЭЭГ не очень надежен или устойчив к шуму, особенно для сигналов, исходящих глубоко в головном мозге. Гораздо более действенный подход – применить дипольную подгонку к отдельным сигналам, которые были выделены алгоритмом коррекции артефактов, таким как ICA или SSP. На практике очень распространено выполнение ICA с дипольной подгонкой.
Footnotes
- https://martinos.org/mne/stable/index.html
- https://martinos.org/mne/stable/manual/c_reference.html
- https://sccn.ucsd.edu/eeglab/
- http://www.fieldtriptoolbox.org/
- http://martinos.org/mne/stable/tutorials/seven_stories_about_mne.html?highlight=fif#what-the-fif-does-mne-stand-for
- http://www.edfplus.info/specs/edfplus.html
- http://martinos.org/mne/dev/manual/io.html
- https://en.wikipedia.org/wiki/Nyquist%E2%80%93Shannon_sampling_theorem
- http://blricrex.hypotheses.org/ressources/eeg/pre-processing-for-erps
- Krigolson Olave E., Williams Chad C., Norton Angela, Hassall Cameron D., Colino Francisco L. Choosing MUSE: Validation of a Low-Cost, Portable EEG System for ERP Research. Frontiers in Neuroscience, volume 11, 2017, p. 109. doi:10.3389/fnins.2017.00109
- ICA in MNE: http://martinos.org/mne/dev/manual/preprocessing/ica.html
- Automated dipole fitting after ICA with practice datasets: http://cognitrn.psych.indiana.edu/busey/temp/eeglabtutorial4.301/dipfittut/dipfit.html
- Makoto’s personal guide on using EEGLAB for ICA and Dipole fitting: https://sccn.ucsd.edu/wiki/Makoto%27s_preprocessing_pipeline
- Background theory of ICA: https://sccn.ucsd.edu/wiki/Chapter_09:_Decomposing_Data_Using_ICA
- Comparing ICA and SSP: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4972935/
- Dipole source localization: https://sccn.ucsd.edu/wiki/A08:_DIPFIT