Измерение внутриклеточной концентрации кальция при помощи флуоресцентных индикаторов
Кальциевый имиджинг (англ. calcium imaging) – микроскопический метод исследования клеточной активности в режиме реального времени, основанный на оптическом измерении концентрации кальция с помощью флюоресцентных индикаторов, которые связываются с ионами кальция и способны излучать свет (флуоресцировать) при активации ультрафиолетом. Кальциевый имиджинг широко используется для изучения активности как отдельных нейронов, так и целых популяций. Принцип метода кальциевого имиджинга основан на том, что при возбуждении клетки в нее поступают ионы кальция, меченные индикатором, что фиксируется в виде свечения.
В организме человека содержится несколько килограммов кальция, однако большая его часть находится в связанном состоянии (например, в костях). Концентрация же ионов кальция (Ca2+) внутри клетки (по сравнению с другими ионами) поддерживается на очень низком уровне. Поскольку кальций является вторичным посредником, то не только небольшое изменение внутриклеточной концентрации Са2+([Са2+]), но также кинетика и/или пространственная (не)однородность этого изменения определяют последовательность реакций, протекающих в клетке. Именно поэтому ученые всегда стремились разработать метод, позволяющий точно измерить флуктуации [Са2+].
Первой попыткой имиджинга были кальцийселективные электроды. Суть метода заключалась в том, что кончик электрода покрывали специальной мембраной, которая была проницаема для Са2+, но непроницаема для других ионов1. И хотя этот метод и позволил получить первичные данные о [Са2+] 23, он имеет ряд ограничений:
- кальцийселективные электроды сложно изготовить;
- введение электрода в клетку часто сопряжено либо с повреждением кальцийселективной мембраны, либо с повреждением самой клетки;
- [Са2+] может быть измерена только в одной точке;
- точность измерения [Са2+] в субмикромолярном диапазоне, т.е. нефизиологических величин, невысока.
Применение биолюминесцентных белков позволило сделать еще один шаг вперед. Связывание иона Са2+ белком экворином (aequorin) приводит к излучению фотона (так называемая люминесценция), который можно зарегистрировать, например, при помощи фотоумножителя. Этот метод позволил измерить [Са2+] в аксоне кальмара45, но он не решил основной проблемы: как доставить экворин внутрь клетки. Экворин – довольно большой белок, плохо проникающий через клеточную мембрану, поэтому основным методом «загрузки» экворина в клетку был гипоосмотический шок. Биолюминесцентный метод позволял исследовать лишь «живучие» клетки, например эритроциты, тогда как более чувствительные клетки, такие как нейроны, загрузить не удавалось.
Применение металлохромных индикаторов, таких как арсеназо-III (arsenazo-III) и антипиралазо-III (antipyralazo-III), решило проблему загрузки красителя в клетки6. Связывание иона Са2+ приводило к изменению спектра поглощения индикатора, таким образом, по изменению последнего можно было судить о [Са2+]. Недостатками этого метода являлись:
- низкое (десятки микромоль) сродство красителя к Са2+;
- необходимость измерять уровень абсорбции, т.е. проводить измерения на просвет, что приемлемо для измерения [Са2+] в изолированных клетках, но сильно ограничивает возможность исследований в ткани, поскольку последняя сама имеет довольно сложный спектр поглощения.
Конфигурация экспериментальной установки
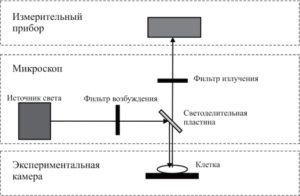
Только с появлением флуоресцентных индикаторов, таких как fura-2 и indo-17, измерение [Са2+] стало простой и выполнимой задачей. Флуоресценция по определению означает, что молекула индикатора способна абсорбировать квант света определенной длины волны (длина волны возбуждения), после чего излучить фотон другой длины волны (длина волны излучения), которая больше длины волны возбуждения. Сдвиг длины волны позволяет разделить возбуждающий и излучаемый свет. Схема экспериментальной установки, необходимой для проведения исследований, представлена на рис. 1. Источником света является обычно ксеноновая или ртутная лампа, хотя можно использовать и лазер.
Преимущества ламп:
- их относительная дешевизна;
- широкий спектр излучения (от ультрафиолетового до инфракрасного света).
Три следующих элемента – фильтр возбуждения, светоделительная пластина и фильтр излучения – представляют собой оптические интерференционные фильтры. Следует отметить, что существует два типа интерференционных фильтров: узкополосные и отсекающие. Узкополосные (narrow-band) фильтры пропускают свет только в каком-то узком диапазоне длин волн.
Важно! Узкополосные фильтры характеризуются двумя параметрами – длина волны света, которая минимально поглощается фильтром (λ), и полуширина диапазона пропускания (λ1/2), т.е. интенсивность пропускаемого света на длинах волн λ±λ1/2 составляет 50% от интенсивности света на длине волны λ (эти параметры написаны на канте фильтра), поэтому сказать, что фильтр возбуждения пропускает свет длиной волны, например, 380 нм, некорректно, потому что это может быть как 380±10 нм, так и 380±30 нм, что может иметь принципиальное значение (см. ниже).
Отсекающие фильтры (longrange) характеризуются длиной волны пропускания (X), при этом свет с более короткой длиной волны поглощается/отражается, а с более длинной проходит. Отсекающие фильтры также характеризуются полушириной отсекания (λ1/2).
Установка с использованием лампы в качестве источника света обычно включает в себя следующие элементы: узкополосный фильтр возбуждения (X выбирают соответственно максимуму спектра поглощения индикатора), светоделительную пластинку и отсекающий фильтр излучения. При этом должны выполняться следующие неравенства:
λ возбуждения + λ1/2 возбуждения < λ пластинки – λ1/2 пластинки
λ пластинки + λ1/2 пластинки > λ излучения – λ1/2 излучения
Несоблюдение этого правила приводит в лучшем случае к потере полезного сигнала, в худшем – возбуждающий свет будет попадать на измерительный прибор и будет регистрироваться сигнал, не имеющий отношения к физиологическому процессу.
Измерительным элементом могут быть: фотоумножитель, цифровая камера или фотодиод/фотодиодная матрица. Наиболее чувствительным прибором является фотоумножитель. К сожалению, этот детектор позволяет измерять сигнал только от одной точки, он неприменим в случае, если требуется измерить пространственное распределение [Са2+] по клетке. В последнем случае, и это сейчас наиболее распространенная конфигурация, применяют цифровую камеру (CCD – charge-coupled device).
Постановка задачи и выбор индикатора
Что измерять: концентрацию Са2+ или нечто, пропорциональное ей?
Параллельно с разработкой и созданием экспериментальной установки важно ответить на вопрос: какой Са2+-индикатор лучше всего подходит для поставленной задачи? Список производимых Са2+зондов весьма обширен. Производит их преимущественно фирма Molecular Probes, которая также создала неплохой каталог (Handbook of Fluorescent Probes and Research Products).
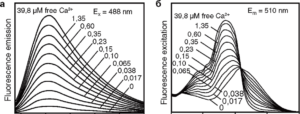
Отметим, что интенсивность флуоресценции Oregon-1 (а, возбуждение Ex=488 нм) растет при возрастании [Са2+], но сам спектр принципиально не изменяется. В случае же Fura-2 (б) сигнал, измеряемый на длине волны света Em=510 нм, растет, если длина волны возбуждения равна 340 нм, и падает, если длина волны возбуждения равна 380 нм
Перед выбором красителя при постановке задачи сначала нужно решить, собираетесь ли вы измерять относительную концентрацию Са2+, полученную в абстрактных единицах, или же абсолютную – в наноили микромолях. В первом случае для исследования подойдут так называемые одноволновые Са2+-зонды, например Calcium Green, Oregon Green BAPTA-1. На изменение [Са2+] они отвечают только изменением интенсивности флуоресценции (рис. 2, а). Так, Oregon Green BAPTA-1 (с длиной волны возбуждающего света, составляющей 490 нм) практически не флуоресцирует при отсутствии ионов Са2+, тогда как при увеличении [Са2+] интенсивность флуоресценции сильно возрастает. При этом очевидно, что амплитуда измеряемого сигнала пропорциональна как [Са2+], так и концентрации самого зонда, а поскольку обе эти величины неизвестны, то получить реальную [Са2+] не представляется возможным. Вместо [Са2+] в статьях обычно приводят параметр (F-F0)/F0, где F – измеряемый оптический сигнал, а F0 – флуоресцентный сигнал перед началом экспериментального протокола, например перед приложением вещества. Таким образом, данные, полученные в эксперименте, позволяют судить о кинетике и относительной амплитуде изменений [Са2+], но не о реальной концентрации Са2+. Если же исследователя интересует абсолютное значение [Са2+], то для достижения поставленной цели больше подойдут Са2+-зонды из семейства Fura или Indo-1. При взаимодействии с Са2+ эти красители изменяют не только интенсивность флуоресценции, но и спектр возбуждения (Fura) или эмиссии (Indo-1). Поскольку работа с Indo-1 требует дорогостоящей модификации оптической части установки8, в этом обзоре мы остановимся на зондах из семейства Fura. Рис. 2, б показывает, что флуоресцентный сигнал, измеряемый на длине волны эмиссии 510 нм, зависит от того, какая была длина волны возбуждения. При возбуждении длиной волны 340 нм интенсивность флуоресценции возрастает с увеличением [Са2+], в то время как при возбуждении светом с длиной волны 380 нм рост [Са2+] приводит к снижению интенсивности флуоресценции. Если предположить, что оба измеряемых сигнала (возбуждение с X 340 и 380 нм) пропорциональны концентрации зонда, то их отношение не должно зависеть от этой концентрации. В связи с этим в статьях часто приводят величину: F380/F340 как аналог [Са2+]. После относительно несложной калибровки экспериментальной установки910 это отношение можно пересчитать в абсолютное значение [Са2+]. Данную процедуру мы здесь рассматривать не будем. Таким образом, измерение реальной [Са2+] возможно, но для этого необходимо попеременно возбуждать Fura двумя длинами волн. Аппаратно в самом простом случае это реализуется следующим образом. Вместо фильтра возбуждения ставят колесо, в котором закреплены два фильтра (X=340 и 380 нм). При вращении колеса длина волны возбуждения периодически меняется, позволяя при соответствующей синхронизации получать параллельно два сигнала. Необходимо отметить, что зонд Fura можно также применять и в качестве одноволнового индикатора.
Сродство зонда к Са2+ и величины ожидаемых изменений [Са2+]
Наиболее важным параметром при выборе красителя является, пожалуй, его сродство к Са2+. Например, семейство Oregon включает в себя 3 Са2+-зонда: Oregon-1, Oregon-2 и Oregon-5N. Физикохимические свойства этих индикаторов (а также их цена) практически идентичны. Единственное отличие – их сродство к Са2+: 200 нМ для Oregon-1, 600 нМ для Oregon-2 и 5 мкМ для Oregon-5N. Не стоит забывать, что почти все Са2+-зонды – производные Са2+-хелатора ВАРТА, и принцип их работы не отличается от работы Са2+-буфера, т.е. описывается следующей кинетической схемой:
зонд + Са2+ ⇄ зонд * Са2+
Kd = kon / koff
где kon и koff – кинетические константы, а сродство определяется как их отношение.
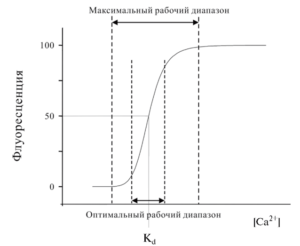
Соответственно, реакция взаимодействия зонда и Са2+ описывается сигмоидальной кривой (рис. 3). Эта кривая показывает, что флуоресценция индикатора не изменяется в определенных диапазонах изменения [Са2+]. Зная сродство зонда к Са2+, можно грубо определить максимальный рабочий диапазон от 0,1xKd до 10xKd. Не стоит при этом забывать, что как при низкой, так и при высокой [Са2+] чувствительность зонда значительно уменьшается. Именно поэтому по возможности рекомендуют измерять [Са2+] в диапазоне, где связь между [Са2+] и флуоресценцией зонда является практически линейной (оптимальный рабочий диапазон – примерно от 0,3xKd до 3xKd).
Таким образом, перед проведением экспериментов следует почитать соответствующую литературу и оценить диапазон ожидаемых физиологических флуктуаций [Са2+]. Например, в мышечных клетках [Са2+] при сокращении может достигать микромолярных величин. Следовательно, из семейства Oregon нужно выбрать зонд Oregon-5N. С другой стороны, амплитуды Са2+-ответов в нейронах составляют 200-300 нМ, поэтому в этом случае лучше использовать зонд Oregon-1.
Загрузка индикатора
Способы загрузки
Следующий вопрос, который возникает после выбора Са2+индикатора, – каким образом загрузить его в клетки? Существует 2 основных способа окрашивания клеток:
- путем внутриклеточного диализа;
- путем инкубации клеток в растворе, содержащем предшественник зонда, способный диффундировать через мембрану.
- первом случае экспериментальная установка должна быть оснащена, по крайней мере, манипулятором, на котором устанавливают держатель пипетки. Еще лучше, если пипетка подключена к patch clamp усилителю – тогда параллельно с оптическими сигналами можно измерять электрофизиологические ответы. Индикатор добавляют во внутриклеточный раствор.
Важно!
- Индикатор нужно брать в форме водорастворимой соли (например, калиевая соль Oregon – Oregon-K5).
- Са2+-зонд – это кальциевый буфер.
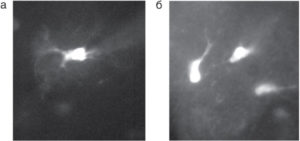
загруженной индикатором Oregon-1 через пипетку (а) и путем инкубации в растворе, содержавшем Oregon-1-AM (б)
В связи с этим другие внутриклеточные Са2+-буферы (обычно берут EGTA или ВАРТА) добавлять в раствор не следует. Типичная концентрация зонда во внутриклеточном растворе составляет 0,30,5 мМ. Сама процедура загрузки проста. Пипетку, заполненную индикаторсодержащим раствором, подводят к клетке и путем приложения отрицательного давления устанавливают плотный контакт с клеткой (giga-seal). После прорыва мембраны, т.е. перехода в конфигурацию whole-cell, происходит заполнение клетки зондсодержащим раствором (рис. 4, а).
Преимущества этого метода:
- концентрация зонда в клетке точно известна;
- если эксперименты проводят в тканях (например, в срезах мозга), то измеряемый сигнал отражает активность только одной клетки, поскольку автофлуоресценцией ткани можно, как правило, пренебречь.
Недостатки:
- диализ клетки может влиять на процессы регуляции [Са2+];
- сложность экспериментальной установки и низкая скорость получения результатов (один эксперимент – одна клетка).
Второй способ, широко распространенный в настоящее время, состоит в использовании мембранно-проницаемой формы красителя, так называемой АМ-формы (например, Oregon-1-АМ). Важно помнить, что АМ-форма нечувствительна к Са2+, другими словами, ее нельзя использовать при загрузке зонда через пипетку. Являясь жирорастворимым веществом, АМ-форма способна проходить через клеточную мембрану. В клетке внутриклеточные эстеразы превращают жирорастворимую АМ-форму в водорастворимый аналог, который уже не может диффундировать через мембрану. Только водорастворимая форма является Са2+-чувствительной. Процесс загрузки индикатора предельно прост. Клетки инкубируют во внеклеточном растворе, содержащем 5-10 мкМ АМ-формы красителя, в течение 20-30 мин. После этого внеклеточный раствор заменяют на обычный физиологический раствор, и еще примерно через 30 мин (время, необходимое для конвертирования АМ-формы в соль внутриклеточными эстеразами) можно начинать эксперимент.
Преимущества данного метода:
- дополнительное оборудование не требуется;
- неинвазивная загрузка; внутриклеточная среда практически (но не абсолютно, см. ниже) не меняется;
- можно одновременно покрасить большое количество клеток (рис. 4, б).
Основной недостаток: внутриклеточная концентрация зонда неизвестна. Поскольку все Са2+-чувствительные зонды являются кальциевыми хелаторами, то это может привести к модификации внутриклеточной регуляции Са2+, что, в свою очередь, может исказить физиологический ответ.
Какова необходимая и достаточная внутриклеточная концентрация зонда?
Точного ответа на сформулированный вопрос нет, поскольку эта концентрация зависит как от свойств (в основном оптической чувствительности экспериментальной установки), так и от исследуемых Са2+-флуктуаций. Рассмотрим их по отдельности.
Во-первых, как в случае одноволновых индикаторов, так и в случае количественного измерения [Са2+] экспериментально получаемый параметр представляет собой отношение (F-F0)/F0 и F380/F340, соответственно). Вот почему чрезвычайно важно следить за тем, чтобы знаменатель не равнялся нулю. Для этого перед экспериментом рекомендуют хотя бы визуально проверить наличие сигнала.
Важно!
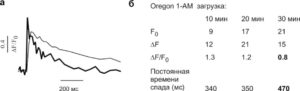
а - ответы, вызванные одним ПД в клетках, загруженных Oregon-1-AM в течение 20 (толстая) и 30 мин (тонкая линия); б - таблица результатов, полученных от клеток, по-разному загруженных индикатором. Обратите внимание, что 30-минутная инкубация приводит к уменьшению амплитуды и замедлению ответа (жирный шрифт)
При работе с Fura используют возбуждающее излучение с длиной волны 340 нм – ультрафиолетовое излучение, которое не проходит через стекло. Таким образом, объектив микроскопа, если это не специальный объектив из кварцевого стекла, работает в этом случае как отсекающий фильтр. Если F380 хорошо различима визуально, а F340 практически равна 0, то мы рекомендуем не пробовать загрузить больше зонда, а провести измерения, используя длины волн возбуждения, равные 380 и 360 нм. Последняя длина волны – фиолетовый свет, который проходит через стеклянный объектив. Более того, это изобестическая точка Fura, т.е. измеряемый сигнал, не зависит от [Са2+] (см. рис. 2, б). И хотя отношение F380/F360 отражает [Са2+] менее точно, чем F380/F340, эта потеря компенсируется дополнительной информацией о концентрации Fura в клетке (знанием того, что эта концентрация не менялась).
Кроме того, желательно, изучив данные литературы, найти какойлибо физиологический стимул, который вызывает более или менее стандартный кальциевый ответ в исследуемых клетках. Например, у нейронов таким стимулом является короткая деполяризация и вызванный ей ПД. В течение ПД открываются потенциалуправляемые Са2+-каналы, в связи с чем изменяется [Са2+]. Поскольку ПД представляет собой ответ по типу «все или ничего», то вызванный им кальциевый ответ тоже практически постоянен. Загружая разные количества индикатора, можно посмотреть, как меняются амплитуда и кинетика вызванного ответа. В случае «перегрузки» клетки, когда индикатор становится доминирующим кальциевым буфером в клетке, амплитуда ответа уменьшается, а его длительность увеличивается. Рис. 5 демонстрирует этот эффект. Видно, что 30-минутная инкубация приводит к существенному искажению ответа. Рекомендованное время загрузки в этом случае составляет 20 мин.
Рекомендуемый протокол загрузки
- Возьмите физиологический раствор, содержащий 10 мкМ АМ-формы индикатора.
Важно! АМ-форма не растворяется в воде, поэтому растворите АМ-форму сначала в диметилсульфоксиде (ДМСО) в концентрации 1 мМ. Поместите по 10 мкл маточного раствора в пластиковые пробирки емкостью 1,5-2 мл и поставьте аликвоты в морозильник (-20 °С); аликвоты можно использовать в течение примерно 1 года. Теперь, добавив 1 мл физиологического раствора, вы получите требуемую концентрацию. Рекомендуется после добавления физиологического раствора потрясти пробирку либо на встряхивателе пробирок (Vortex), либо просто в руках.
- Поместите клетки в приготовленный раствор на 20 мин при комнатной температуре.
- Дважды отмойте клетки нормальным физиологическим раствором.
Если флуоресцентный сигнал слишком мал, попробуйте предпринять следующее:
- увеличьте время инкубации до 30-40 мин;
- добавьте к зондсодержащему раствору 0,02% Плюроника Ф-127 (Pluronic F-127) и повторите протокол (Плюроника Ф-127 – детергент, который делает клеточную мембрану более проницаемой);
- попробуйте инкубировать клетки при 36 °С; так как при такой температуре АМ-форма может попасть в эндоплазматический ретикулум и митохондрии, не рекомендуется инкубировать дольше 20 мин;
- увеличьте концентрацию АМ-формы до 20-50 мкМ;
- попробуйте использовать другой индикатор; некоторые клетки не загружаются определенным зондом, хотя другие индикаторы окрашивают их сравнительно хорошо (см. ниже).
Выбор времени экспозиции и частоты измерений
Большинство современных оптических установок позволяет освещать исследуемый объект только во время измерения. Например, возбуждающий свет подается в течение 100 мс, и кумулятивный оптический сигнал регистрируется цифровой камерой. Если известно, что длительность кальциевого ответа равна, например, 20 с, то можно сказать, что, проводя измерения с частотой 1 Гц (одна точка в 1 с), мы существенно не исказим физиологический ответ. Таким образом, после получения одной точки (100 мс освещения), можно сделать паузу 900 мс, в течение которой возбуждающий свет не подается.
Минимизация времени освещения важна, поскольку возбуждающий свет, кроме полезной функции (возбуждение флуоресценции), может разрушить молекулу Са2+-чувствительного красителя (photobleaching). Это может иметь следующие негативные последствия. Во-первых, уменьшается концентрация красителя. Если применяют одноволновый краситель, сигнал, пропорциональный [Са2+] и выраженный, как (F-F0)/F0, будет изменяться, даже если [Са2+] останется неизменной, вследствие чего отличить выгорание зонда от физиологического ответа будет довольно сложно. В этом случае рекомендуют поварьировать время экспозиции. Если наблюдаемый «ответ» зависит от экспозиции, то это, скорее всего, выгорание красителя. Если кинетика выгорания значительно медленнее, чем кальциевый ответ, то можно применить коррекцию выгорания (fade-correction). При этом предполагается, что выгорание – линейная функция времени. Таким образом, имея величины F0 до приложения вещества (F01) и после окончания действия (F02), а также время между измерениями (t), можно представить F0 как линейную функцию времени:
F0 (t) = F01 – ((F01 – F02)/t) x Δt
где Δt – временной промежуток между экспериментальными точками.
В случае двухволновых красителей ситуация выглядит проще. Поскольку скорость выгорания для обеих длин волн в нулевом приближении одинакова, то в большинстве случаев можно пренебречь влиянием выгорания на параметр F380/F340. Тем не менее необходимо учитывать, что оба семейства двухволновых красителей (Fura и Indo) образуют токсические вещества при фотоиндуцированном разрушении, поэтому выгорание ведет не только к уменьшению полезных сигналов, но и может существенно влиять на внутриклеточные процессы (phototoxicity). Скорректировать эти эффекты можно, только минимизировав время освещения.
Рекомендуемая последовательность действий для создания оптимального протокола эксперимента представлена ниже.
- Выбрать минимально достаточное время экспозиции – такое, чтобы величина F0 была значительно (по крайней мере в 3 раза) больше, чем шумовой сигнал (флуоресценция от зоны, не содержащей клеток).
- Найти в литературе или самостоятельно несколько раз измерить длительность исследуемого физиологического ответа (t).
- Установить частоту измерений, равную примерно 1/20 х t.
- Если в качестве измерительного прибора вы используете фотоумножитель, попробуйте усилить его чувствительность путем увеличения напряжения на ускоряющих динодах. Это позволит уменьшить время экспозиции.
Загрузка определенного типа клеток
В этом разделе мы бы хотели рассмотреть особенности проведения исследований многоклеточных препаратов. В качестве примера рассмотрим срезы мозга. Мозг состоит из клеток, которые отличаются как по своим функциям (например, возбудимые нейроны и невозбудимые глиальные клетки), так и по размерам (размер сомы может быть от нескольких микрон – например, гранулярные клетки мозжечка, до сотни микрон – клетки Пуркинье мозжечка). В связи с этим естественно предположить, что кальциевые зонды будут окрашивать различные клетки по-разному. Кроме того, поскольку исследования, проведенные на идентифицированных клетках, уменьшают количество экспериментов (вариабельность ответов меньше) и увеличивают значимость результата (приближение к физиологической функции этих клеток), то попытки загрузить только определенную популяцию клеток предпринимались неоднократно.
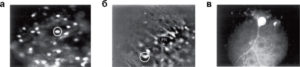
а - 10-минутная инкубация окрашивает только мелкие гранулярные клетки; б - 20-минутная инкубация приводит к окраске Бергманновской глии, но Пуркинье-нейроны (PN) остаются практически не флуоресцентными; в - через 40 мин флуоресцентный сигнал от Пуркинье-нейронов уже можно регистрировать
Первый подход основывается на следующем рассуждении. Поскольку загрузка индикатора происходит путем его диффузии через мембрану, то, предполагая, что мембраны клеток сходны, количество загруженного красителя пропорционально площади мембраны. Концентрация же зонда в клетке обратно пропорциональна ее объему. Поскольку площадь мембраны пропорциональна квадрату радиуса клетки, а ее объем – кубу радиуса, то более мелкие клетки должны загружаться быстрее. Действительно, 10-минутная инкубация срезов мозжечка в растворе, содержащем 10 мкМ Fura-2-AM, приводила к специфической загрузке гранулярных клеток, 20-минутная инкубация – клеток Бергманновской глии и 40-минутная – к окраске клеток Пуркинье (рис. 6,11). Именно поэтому при проведении исследований многоклеточных препаратов мы рекомендуем варьировать время загрузки с целью уменьшения фоновой покраски и получения однородной популяции клеток. Вышеприведенный подход основывался на предположении, что мембраны клеток похожи по своим физико-химическим свойствам, по крайней мере, для диффузии Са2+-чувствительных зондов. Это, по-видимому, не всегда верно. Например, индикатор Fluo-4-AM хорошо проходит через мембраны глиальных клеток, но практически не окрашивает нейроны1213, поэтому, если исследуемые клетки не окрашиваются одним зондом, необходимо изучить литературу, возможно, эксперимент получится, если взять другой индикатор.
Footnotes
- Gorman A.L., Levy S, Nasi E, Tillotson D. Intracellular calcium measured with calcium-sensitive micro-electrodes and Arsenazo III in voltage-clamped Aplysia neurones // J. Physiol. – 1984. – Vol. 353. -127-142.
- Levy S., Tillotson D. Ability of the Са2+-selective microelectrodes to measure fast and local Са2+ transients in nerve cells // Can. J. Physiol. – 1987. – Vol. 65. – P. 904-914.
- Morris M.E., Krnjevic K., MacDonald J.F. Changes in intracellular free Ca ion concentration evoked by electrical activity in cat spinal neurons in situ // Neuroscience. – 1985. – Vol. 14. – P. 563-580.
- Baker P.F., Hodgkin A.L., Ridgway E.B. Depolarization and calcium entry in squid giant axons // J. Physiol. – 1971. – Vol. 218. – P. 709-755.
- DiPolo R, Requena J., Brinley F.J. Jr. et al. Ionized calcium concentrations in squid axons // J. Gen. Physiol. – 1976. – Vol. 67. – P. 433-467.
- Baylor S.M., Chandler W.K., Marshall M.W. Use of metallochromic dyes to measure changes in myoplasmic calcium during activity in frog skeletal muscle fibres // J. Physiol. – 1982. – Vol. 331. – P. 139-177.
- Grynkiewicz G, Poenie M, Tsien R.Y. A new generation of Са2+ indicators with greatly improved fluorescence properties // J. Biol. – 1985. – Vol. 260. – P. 3440-3450.
- June C.H., Rabinovitch P.S. Flow cytometric measurement of intracellular ionized calcium in single cells with indo-1 and fluo-3 // Methods Cell Biol. – 1990. – Vol. 33. – P. 37-58.
- Grynkiewicz G, Poenie M, Tsien R.Y. A new generation of Са2+ indicators with greatly improved fluorescence properties // J. Biol. – 1985. – Vol. 260. – P. 3440-3450.
- Kirischuk S., Pronchuk N, Verkhratsky A. Measurements of intracellular calcium in sensory neurons of adult and old rats // Neuroscience. – 1992. – Vol. 50. – P. 947-951.
- Kirischuk S., Verkhratsky A. [Са2+]i recordings from neural cells in acutely isolated cerebellar slices employing differential loading of the membranepermeant form of the calcium indicator fura-2 // Eur. J. Physiol. – PfHigers Archiv. – 1996. – Vol. 431. – P. 977-983.
- Mishima T., Sakatani S, Hirase H. Intracellular labeling of single cortical astrocytes in vivo // J. Neurosci. – 2007. – Vol. 166. -32-40.
- Stosiek C., Garaschuk O., Holthoff K., Konnerth A. In vivo two-photon calcium imaging of neuronal networks. – Proceedings of the National Academy of Sciences of the United States of America – 2003. – Vol. 100. – P. 7319-7324.