Метод «слепого» patch-clamp
➥ Основная статья: Patch clamp метод
Метод «слепого» patch-clamp заключается в том, что экспериментатор продвигает электрод в глубину среза, по направлению скопления клеток, не пытаясь при этом визуально идентифицировать отдельные клетки. Данный метод был использован впервые для регистрации синаптических токов и свойств мембран нейронов на срезах мозга черепахи и крысы в конфигурации whole-cell при фиксации тока и фиксации потенциала1. Приближение к мембране клетки и образование гигаомного контакта распознается по ответу на подаваемый ток. В данной постановке эксперимента допустимо использование относительно толстых срезов мозга (400-500 мкм). Общее положение структур на срезе мозга контролируют при помощи бинокуляра. При отведении от целой клетки в клетку может быть введен биоцитин, что позволяет в дальнейшем охарактеризовать клетку гистологически. Использование метода patch-clamp вслепую имеет свои преимущества: для проведения подобного эксперимента не требуется использования дорогой оптической техники. Дополнительное преимущество данного экспериментального подхода заключается в том, что электрическая активность может быть успешно зарегистрирована у клеток, находящихся в глубине среза. Однако «слепой» patch-clamp может уступать другим методам patch-clamp, использующим визуализацию клеток при помощи оптической техники, по качеству гигаомного контакта и качеству записи в целом.
Patch-clamp в срезах мозга при помощи метода очищения
Метод patch-clamp на идентифицированных визуально нейронах впервые был применен при использовании микроскопа с 40-кратным увеличением для patch-clamp регистрации мембранного потенциала, суммарных токов и токов через одиночные каналы на срезах головного и спинного мозга крысы, мыши и кошки разного возраста2. В результате удалось показать методическую состоятельность данного подхода для решения широкого спектра электрофизиологических задач, в том числе с применением флуоресцентных красителей. Сначала авторы использовали пипетку довольно большого диаметра (10-20 мкм) для очистки поверхности выбранной клетки от клеточного дебриса до тех пор, пока поверхность клетки не была освобождена для того, чтобы приблизиться к клетке, используя другую пипетку (patch-пипетку). Выбор клетки, очистка ее поверхности, а также все операции с patch-пипеткой проводятся в данном случае при непосредственном наблюдении всех процессов через объектив микроскопа с использованием водной иммерсии.
Контраст, достигаемый при инфракрасном освещении, тем не менее не всегда достаточен, даже при использовании соответствующей оптики. Дополнительное усиление контраста в 5-10 раз может быть достигнуто при применении видеокамер, разработанных для клеточной биологии, например камер фирмы Hamamatsu (Japan). Подобные камеры относятся к разряду ПЗС-устройств (прибор с зарядовой связью). Эксперименты с использованием подобных камер показали, что добиться дальнейшего увеличения контраста в глубоких слоях среза можно при наличии света с большей длиной волны.
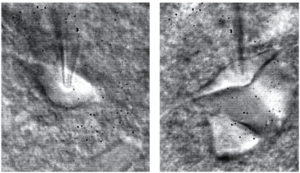
При выполнении подобного эксперимента в пипетку подается небольшое положительное давление (20-100 мБар), которое предотвращает засорение кончика пипетки по мере его продвижения в ткани среза, а также выполняет функцию очищения поверхности нейрона. Фактически в данном случае исследователь имеет дело со смешанной техникой, однако для очищения выбранного ареала не применяют дополнительную пипетку. Обычно сначала рекомендуют найти клетку, соответствующую необходимым параметрам при помощи инфракрасной микроскопии (рис. 3). Затем следует поместить пипетку в ячейку держателя и подать давление. Следующий шаг состоит в том, чтобы при помощи манипулятора расположить кончик пипетки в середине поля зрения. При участии манипулятора кончик пипетки должен быть опущен в раствор непосредственно над выбранным ареалом для пэтча (patch). На этом этапе обычно происходит смена объектива (5-кратное увеличение заменяют на 40-кратное). Все последующие операции требуют использования системы водной иммерсии. На экране монитора экспериментатор находит тень пипетки и при помощи манипулятора двигает пипетку таким образом, чтобы кончик пипетки оказался в центре поля зрения, после чего наводит фокус на кончик пипетки. Затем при осторожной работе с тонкой фокусировкой микроскопа выбирают (находят предварительно выбранную) клетку. Перемещая фокус с клетки на пипетку и обратно, продвигают пипетку по направлению к клетке до тех пор, пока не достигнут ее поверхности. При этом необходимо контролировать сохранение положительного давления в пипетке. Когда кончик пипетки достигает поверхности клетки, положительное давление убирают, и клетка «налипает» на пипетку, образуя в идеальном варианте гигаомный контакт с пипеткой. Если этого не произошло, то на пипетку можно подать небольшое отрицательное давление, тем самым стимулируя слипание кончика пипетки и клетки.
Возможности применения конфигурации whole-cell на срезах мозга для регистрации К+-токов
Отведение электрофизиологической активности на срезах мозга в конфигурации whole-cell позволяет регистрировать суммарные натриевые, кальциевые, хлорные, калиевые токи. Для регистрации суммарного тока определенной природы необходимо правильно подобрать соответствующий пипеточный раствор. Рассмотрим это на примере записи К+-тока аномального выпрямления. Данный ток играет большую роль при потенциалах на мембране, близких к потенциалу покоя клеток различных тканей, в том числе нейронов и кардиомиоцитов. В подобном эксперименте возможно использование пипеточного раствора следующего состава (мМ): глюконат калия – 95; цитрат калия – 20; NaCl – 10; HEPES – 10; MgCl2 – 1; CaCl2 – 0,1; KBAPTA – 1; Mg-АТФ – 3; Na-ГТФ – 0,5 (pH=7,2 при помощи KOH). Однако какой бы суммарный ток мы ни предполагали регистрировать на клетках срезов мозга, первоначально необходимо охарактеризовать клетку в условиях фиксации тока (current-clamp). Для этого обычно используют стандартные протоколы, где клетка деполяризуется и гиперполяризуется при помощи подачи тока разной амплитуды (например, ступенчатая деполяризация с шагом 10 пА длительностью 1 с). Активность нейрона первоначально записывают при потенциале покоя на мембране клетки, который является очень важным параметром, характеризующим клетки. Так, при регистрации нейронов миндалины клетки с потенциалом меньше -55 мВ обычно исключают из дальнейшего анализа. Впоследствии же для сравнения клеток между собой в ряде экспериментов имеет смысл производить запись активности, деполяризуя клетку от единого потенциала, например, -60 мВ или -70 мВ, так как частота ПД зависит напрямую от потенциала на мембране. После того как клетка была охарактеризована в режиме фиксации тока, необходимо перейти в конфигурацию фиксации потенциала (voltage-clamp). Для записи К+-тока аномального выпрямления клетку гиперполяризуют от потенциала -70 до -140 мВ в течение 300 мс с частотой 0,05 Гц. Возникающий при этом ток и есть К+-ток аномального выпрямления. После того как суммарный ток или его изменение под действием исследуемого вещества были зарегистрированы, необходимо доказать, что данный ток переносится определенными ионами посредством определенных каналов. При проведении подобных экспериментов следует определять потенциалы реверсии регистрируемых токов. В нашем примере потенциал реверсии должен соответствовать калиевому равновесному потенциалу (-104,1 мВ), рассчитанному с помощью уравнения Нернста . Подтвердить гипотезу о том, что переносчиками являются ионы калия возможно, если изменять концентрацию калия в перфузионном растворе и анализировать при этом изменение потенциала реверсии. Следующим шагом будет фармакологическое блокирование канала с применением, например, упомянутого выше тетродотоксина в случае быстрых натриевых каналов. В нашем случае применяли хлорид бария, который в микромолярных концентрациях обратимо блокирует К+-ток аномального выпрямления. Кроме этого, активация К+-тока аномального выпрямления в нейронах требует наличия G-белков. Данный факт может быть проконтролирован, если Na-ГТФ в пипеточном растворе будет заменен негидролизуемыми аналогами гуанозинтрифосфата (ГТФ), например ГТФ-β-S. Таким образом, зарегистрировав некоторый суммарный ток в клетке, необходимо подтвердить, что это именно тот ток, который мы предполагаем. Рассмотренный нами К+-ток аномального выпрямления играет важную роль в функционировании нейронов головного мозга, ак как его активация приводит к изменению потенциала на мембране клетки в сторону гиперполяризации, что вызывает торможение нейрона. Данный ток, в частности, активируется в нейронах мозга в присутствии целого ряда биологически активных пептидов: орфанина, соматостатина и нейропептида У.
Флуоресцентные маркеры на срезах мозга – возможность различать типы клеток a priori
Обработка информации в центральной нервной системе основана на тонком взаимодействии возбуждающих и тормозных нейронов. Большинство возбуждающих нейронов использует в качестве медиатора глутамат. Наиболее распространенный тормозной медиатор в центральной нервной системе – у-аминомасляная кислота (ГАМК). Обычно установить природу нейрона удавалось только по завершении эксперимента при помощи иммуногистохимических методов.
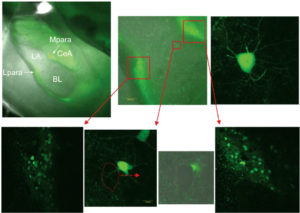
Однако с развитием представлений о тормозных системах мозга возникла острая необходимость распознавания ГАМКергических клеток в живых системах. Один из наиболее популярных методов в настоящее время основан на использовании зеленого флуоресцирующего белка (green fluorescent protein – GFP), впервые обнаруженного у медуз. В начале третьего тысячелетия группа японских ученых получила линию гибридных мышей, у которых зеленый флуоресцирующий белок экспрессируется под управлением GAD67-промотора3. Глутаматдекарбоксилаза 1 (GAD67) является одним из ферментов, синтезирующих ГАМК. Таким образом, ГАМКергические нейроны приобретают зеленое флуоресцентное окрашивание в живом организме (в организме мыши). Использование срезов мозга подобных животных позволяет различать природу клеток до проведения электрофизиологического эксперимента, что значительно облегчает процесс выбора соответствующих клеток для анализа (рис. 4).
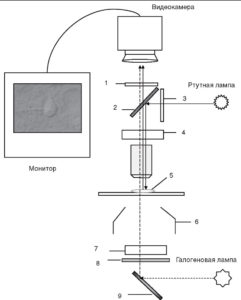
Вместе с тем patch-clamp установка для работы с подобными срезами требует некоторого усовершенствования. Это касается в первую очередь микроскопа. Флуоресценция белка не видна в обычных условиях. Для того чтобы увидеть «зеленые клетки» на срезах мозга, микроскоп должен быть оснащен специальным набором флуоресцентных фильтров. Дифференциальная интерферентная микроскопия позволяет сочетать использование флуоресцирующих белков с обычным электрофизиологическим экспериментом. Соответствующая схема устройства микроскопа, который может быть использован в подобном эксперименте, представлена на рис. 5. Принцип флуоресцентной микроскопии основан на том, что источник излучения для возбуждения флуоресценции производит свет заданной длины волны (монохроматический свет) либо свет необходимой длины волны достигается при прохождении света через возбуждающий фильтр (λ1). Дихроичное зеркало отражает свет по направлению к препарату. Флуоресцирующий белок (краситель) эммитирует свет длиной волны λ2 (λ2 >λ1), который проходит через дихроичное зеркало, преобразуется при прохождении через отсекающий фильтр и регистрируется при помощи видеокамеры. Одним из микроскопов, соответствующим данным требованиям, является, например, микроскоп Axioskop 2FS фирмы Zeiss.
Комбинирование метода patch-clamp и метода обратной транскрипции для молекулярного анализа одиночной клетки
В последние годы с помощью молекулярно-биологических методов было показано, что многие ионные каналы и рецепторы, помимо различия в их биофизических и фармакологических характеристиках, состоят из различных субъединиц. В течение продолжительного времени не представлялось возможным определить, какие именно субъединицы определенного типа экспрессируются в одиночной клетке. Новый метод, объединяющий patch-clamp и обратную транскрипцию на одиночной клетке, позволяет устанавливать корреляцию между электрофизиологическими параметрами клеток и наличием в них соответствующих транскриптов; он может быть применен для выяснения соотношений между электрофизиологическими параметрами клеток и экспрессией молекулярных маркеров.
Общие правила работы в лаборатории с применением молекулярно-биологических методов
Для того чтобы предотвратить активность РНКаз и избежать деградации клеточной рибонуклеиновой кислоты (РНК), все пипетки, пробирки, стекло, пластик в лаборатории должны быть автоклавированы с использованием оксида этилена. Поверхности рабочих столов, пипетки, диспенсеры, центрифуги необходимо периодически обрабатывать спреем, блокирующим активность РНКаз, например RNAse AWAYTM (Molecular Bioproducts, San Diego, CA) для предотвращения активности РНКаз и ДНК-контаминации (ДНК – дезоксирибонуклеиновая кислота). Лабораторные перчатки не следует снимать на протяжении всего эксперимента, включающего подготовку растворов, биологического материала и постановку реакций. Для постановки реакций рекомендован к использованию специальный пластик, обработанный против ДНКаз и РНКаз.
Контаминация к-ДНК, которую предполагается амплифицировать, может легко привести к ложноположительным результатам. Именно поэтому выделение и подготовку РНК и постановку полимеразной цепной реакции (ПЦР) необходимо проводить в раздельных комнатах. Кроме того, все необходимые пипетки и прочее оборудование должны быть разнесены в пространстве во избежание попадания продуктов амплификации в растворы, используемые для коллектирования клеток. Помимо соблюдения общих правил лабораторной молекулярно-биологической практики следует включать в экспериментальную постановку необходимые отрицательные контроли, детальное рассмотрение которых будет представлено при анализе возможных ошибок.
Коллектирование клеток из срезов мозга для дальнейшего анализа
При проведении электрофизиологического эксперимента с последующим забором цитоплазмы в пипетку следует соблюдать особые меры предосторожности, чтобы не допустить деградации РНК в процессе записи. Для того чтобы предотвратить загрязнение РНКазами и нуклеотидами из внешней среды, растворы, необходимые для электрофизиологического эксперимента, должны быть приготовлены в отдельной комнате с соблюдением правил, указанных выше. Обязательно использование одноразовых лабораторных перчаток для приготовления растворов в течение эксперимента и особенно при манипуляциях со стеклянной пипеткой и электродом. Поверхности манипулятора для изготовления электродов, поверхности микроскопа и других приборов в установке перед экспериментом должны быть обработаны пропанолом или этанолом. Особое внимание следует уделять регулярному (не реже 1 раза в неделю) хлорированию электрода.
Сверхчистая вода (тип I) должна быть использована для приготовления перфузионных растворов. Для приготовления пипеточных растворов следует применять только специальные реагенты (molecular biology clean), а также специальную воду, не содержащую диэтилпирокарбоната, например производства фирмы Ambion. После доведения рН-раствора до нужной величины (рН-электрод предварительно должен быть обработан водой и этанолом) и осуществления контроля осмолярности, аликвоты пипеточного раствора должны быть быстро заморожены; их нужно хранить при -20 °С до дальнейшего использования. Вероятность обнаружения различных транскриптов на одиночном нейроне снижается, если время электрофизиологической записи превышает 15 мин. Скорее всего, это происходит в результате разведения клеточной мРНК (матричной РНК) в пипеточном растворе и из-за активности РНКаз. Влияния РНКаз можно избежать, если в пипеточный раствор добавить РНКазин (ингибитор РНКаз) в количестве 0,25 ЕД/мкл раствора (40 ЕД/мкл RNAsinTM, Promega). Раствор готовят каждый день; во время эксперимента он должен быть постоянно охлажден.
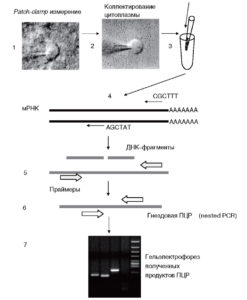
Пипетки для данного эксперимента обычно изготавливают из боросиликатного стекла. Кончик пипетки можно считать стерильным, так как при вытягивании стекло разогревается до высокой температуры. Пипетки обычно заполняют 6 мкл пипеточного раствора с применением одноразовых вытянутых полиэтиленовых наконечников. Желательно избегать добавления в пипеточный раствор буферов для обратной транскрипции или дезоксинуклеотидтрифосфатов, так как это может привести к изменению ионного состава и осмолярности раствора. Сопротивление стеклянных пипеток необходимо подбирать в соответствии с типом и размером клетки. Обычно диапазон 2-6 МΩ, позволяет получать стабильные электрофизиологические отведения с последующим коллектированием клетки. В момент коллектирования клетки в пипетку подается отрицательное давление и содержимое клетки перетекает в кончик пипетки. Параллельно необходимо контролировать на экране осциллографа сохранение гигаомного контакта. По возможности клетку вытягивают с поверхности среза и окончательно коллектируют под контролем инфракрасной микроскопии (рис. 6). Только аккуратно сколлектированные одиночные клетки без остатков дополнительной ткани на пипетке могут быть использованы для дальнейшего анализа.
После забора цитоплазмы пипетку переносят в пробирку, содержащую 3 мкл воды, обработанной диэтилпирокарбонатом. Кончик пипетки обламывают в пробирке, и содержимое пипетки переносят в раствор (около 3 мкл) при помощи подачи положительного давления. Таким образом цитоплазма смешивается с водой, содержащейся в пробирке. После короткого центрифугирования пробирку замораживают в жидком азоте. По окончании эксперимента сколлектированные клетки помещают в холодильную камеру (-80 °С), где клетки могут сохраняться в течение по крайней мере нескольких месяцев до проведения реакции обратной транскрипции.
Обратная транскрипция и полимеразная цепная реакция на одиночном нейроне
Эффективная обратная транскрипция РНК в к-ДНК – совершенно необходимое условие для дальнейшего успешного проведения ПЦР. Обычно реакция обратной транскрипции осуществляется в малом объеме (около 10 мкл) с использованием гексарандом-праймеров (см. рис. 6), которые считают предпочтительными, так как праймеры связываются со всеми комплементарными участками даже в случае отдельных фрагментов мРНК. Однако применение классических олиго(сГГ)-праймеров также допустимо. В качестве фермента для реакции обратной транскрипции используют транскриптазу из Moloney murine leukemia virus (MMLV), несущую РНКаза-Н-делецию (RNAse H-; Superscript IITM; Invitrogen), или новый фермент ретровирусной природы, предназначенный специально для обратной транскрипции малых количеств РНК (SensiscriptTM; Quigen Hilden, Germany).
Для проведения обратной транскрипции на одиночном нейроне может быть использован следующий протокол. К полученному раствору РНК объемом около 6 мкл прибавляют инкубационную смесь, содержащую буфер для обратной транскрипции, дезоксинуклеотидтрифосфаты dNTPs (конечная концентрация – 4×250 мкМ), гексарандом-праймеры (конечная концентрация – 50 мкM), RNAsin, до 20 ЕД, обратная транскриптаза (Sensiscript) – 1 мкл. Общий объем пробы – около 10 мкл. Для того чтобы избежать изменения объема пробы, перед инкубацией ее заливают 1 каплей минерального масла.
Следует отметить, что в случае обратной транскрипции мРНК одиночной клетки выделение РНК обычно не производят во избежание потерь материала. То есть обратную транскрипцию можно проводить в той же пробирке, в которой хранилась глубокозамороженная клетка, добавив соответствующие реакционные компоненты (см. выше) и инкубируя содержимое пробирки 60 мин при 37 °С. Полученная таким образом к-ДНК может быть использована немедленно для дальнейших реакций или заморожена (-20 °С).
Метод обратной транскрипции дает возможность определить экспрессию нескольких генов, включая клеточные маркеры или семейства генов, на одиночной клетке, которая была предварительно охарактеризована электрофизиологически. Подобный метод, когда в ПЦР используют больше 2 праймеров одновременно, называется multiplex и требует обязательной оптимизации праймеров и условий ПЦР. Для амплификации генов, принадлежащих к одному семейству, могут быть применены неспецифичные праймеры, расположенные в консервативных участках гена. Дизайн праймеров в этом случае допускает наличие до 2 некомплементарных нуклеотидов, тогда как 6 нуклеотидов на 3-м конце должны полностью совпадать.
Для проведения multiplex-ПЦР может быть использован следующий протокол для объема 50 мкл. К полученному раствору к-ДНК объемом около 3 мкл добавляют инкубационную смесь, содержащую ПЦР-буфер, MgCl2 (конечная концентрация – 2,5 мM), праймеры (конечная концентрация – 200 нM каждый), рекомбинантную Taq-полимеразу – до 5 ЕД в смеси. dNTPs на данном этапе не требуются (присутствуют в конечной концентрации 4×50 мкМ после разведения продукта, полученного в результате обратной транскрипции).
В первой ПЦР-реакции используют обычно от 30 до 45 циклов. Типичный ПЦР-цикл может быть таким: начальный прогрев при 95 °С в течение 5 мин, инкубация при 85 °С в течение 1 мин (в это время рекомбинантную Taq-полимеразу (Invitrogen) добавляют непосредственно в реакционную смесь), 30-45 циклов, состоящих из этапов денатурации (95 °С в течение 45 с), отжига (51 °С в течение 40 с), элонгации (72 °С в течение 30-60 с). В целом необходимо руководствоваться правилом, в согласии с которым температура отжига праймеров всегда должна быть ниже температуры плавления праймеров. При этом время отжига праймеров для первых 5 циклов увеличено до 2 мин и составляет 45 с для последующих циклов, а время элонгации в последнем цикле увеличено до 7 мин. Полученный продукт может быть очищен при помощи одного из методов очистки ПЦР-продуктов, например с использованием фильтра.
Во втором раунде ПЦР (nested) участвует продукт, полученный в результате первой амплификации. При этом для реакции берут 3 мкл очищенного продукта и новые праймеры. Если оба праймера расположены внутри предварительно амплифицированного участка, то их называют гнездовыми (nested); в случае, если только один праймер новый и расположен внутри амплифицированного продукта, а второй используемый праймер идентичен таковому в первом раунде амплификации, то такие праймеры называют полугнездовыми (heminested). Праймеры, применяемые во втором раунде преамплификации, должны быть специфичными для определенного гена для того, чтобы избежать амплификации родственных молекул.
Для проведения nested-ПЦР может быть взят следующий протокол для объема 50 мкл.
К раствору к-ДНК, полученному в результате первой амплификации, объемом до 3 мкл добавляют инкубационную смесь, содержащую ПЦР-буфер, MgCl2 (конечная концентрация – 2,5 мM), праймеры (конечная концентрация – 200 нM каждый), dNTPs (в конечной концентрации – 4×50 мкМ), Platinum Taq-полимеразу – до 2,5 ЕД в смеси.
Во втором раунде ПЦР количество циклов обычно уменьшают до 20-35 и используют Platinum Taq-полимеразу (Invitrogen), активация которой происходит при высокой температуре (hot start). Температуру отжига устанавливают в соответствии с особенностями праймеров (обычно выше, чем для первой амплификации). Оптимальные условия для второго раунда амплификации подбирают, изменяя концентрацию MgCl2 и температуру отжига. В качестве отрицательного контроля ПЦР применяют воду вместо к-ДНК. Постановка других необходимых контролей будет подробно рассмотрена ниже.
Для идентификации полученных продуктов пользуются гельэлектрофорезом. Электрофорез в агарозном геле позволяет легко, без применения изотопов, обнаружить амплифицированную ДНК и определить ее размер. Амплифицированную ДНК (10-20 мкл) разделяют в 1,5-2% агарозном геле, содержащем бромистый этидий, вместе со стандартными фрагментами ДНК, соответствующими по длине ожидаемым продуктам. Полученный гель анализируют в ультрафиолетовом свете и фотографируют.
Предотвращение возможных ошибок при анализе мРНК одиночной клетки
Несмотря на многочисленные возможности, которые открываются с использованием рассмотренного метода, необходимо весьма аккуратно относиться к подобным экспериментам во избежание потенциальных ошибок.
Начнем с рассмотрения необходимых контролей, которые требуется поставить перед выполнением подобной серии экспериментов.
Во-первых, перед началом экспериментов по определению экспрессии генов на одиночной клетке все реакции необходимо провести на суммарной матричной РНК (мРНК), выделенной из мозга экспериментального животного. При этом важным контролем является отрицательный контроль во время шага обратной транскрипции, т.е. параллельно обычной постановке реакции необходимо поставить отрицательный контроль, где вместо обратной транскриптазы используется вода. Данный контроль имеет особенно большое значение, так как он позволяет отсечь возможную амплификацию геномной ДНК. Общее правило, которым желательно руководствоваться при подборе праймеров, гласит, что праймеры должны быть расположены в различных экзонах. Если подбора подобных праймеров достичь не удается (ген состоит только из одного экзона), перед постановкой обратной транскрипции необходимо провести ДНКазную обработку (Rnase-free DNAse I, Roche), которая приводит к элиминации клеточной ДНК. ДНКазная обработка имеет особое значение при анализе одиночных клеток, так как во время коллектирования содержимого клетки весьма вероятно попадание ядра клетки вместе с цитоплазмой в пипетку.
Во-вторых, эффективность амплификации различных генов, используемых в конкретном multiplex-ПЦР, должна быть проверена при разных разведениях суммарной РНК. Особое внимание следует уделить минимальным концентрациям (250 пг – 1 нг), соответствующим содержанию мРНК в одиночном нейроне. Необходимость данного контроля обусловлена тем, что в условиях multiplex-ПЦР амплификация одного гена может ингибировать накопление к-ДНК, соответствующее другому гену, и влиять таким образом на конечный результат (ложноотрицательный результат).
В-третьих, специфичность полученных ПЦР-продуктов необходимо проверить по крайней мере одним из доступных методов. Например, с использованием рестрикционного анализа или прямым секвенированием полученного продукта.
В-четвертых, важный дополнительный контроль – параллельная постановка реакции, где в качестве исходного материала применяют раствор для перфузии, не содержащий клетку, который забирают в пипетку параллельно основному эксперименту. Данный контроль должен быть всегда отрицателен, он позволяет оценить чистоту реактивов и установки в целом.
Применение электрофизиологического подхода в сочетании с анализом экспрессии генов одиночной клетки для описания нейронов миндалины
Анализ экспрессии генов на отдельной клетке позволяет, в частности, установить взаимосвязь между электрофизиологическими параметрами клетки и экспрессией молекулярных маркеров в цитоплазме того же самого нейрона. Данный метод приобретает особое значение при описании разных типов клеток в ядрах головного мозга. Впервые он был применен для описания клеток Пуркинье мозжечка4. Затем появилась целая серия работ по поводу особенностей электрофизиологии и экспрессии генов в клетках различных участков мозга. Особый интерес представляет идентификация различных популяций глутаматергических нейронов и ГАМКергических нейронов (интернейронов) в ядрах миндалины. Миндалина вовлечена в регуляцию важных физиологических функций организма, таких как эмоциональное поведение, обучение и память, а также различных патофизиологических состояний, а именно: эпилепсия, нарушение эмоционального равновесия, страхи и т.д. Расположение нейронов в миндалине не имеет, в отличие от коры, четкой структурной организации, и клеточный субстрат данного ареала мозга до последнего времени был изучен недостаточно. Данный подход позволил впервые охарактеризовать нейроны латеральной миндалины крысы с точки зрения электрофизиологии и экспрессии клеточных маркеров5. Изначально клетки миндалины были охарактеризованы в patchclamp эксперименте в условиях фиксации тока. При этом для каждой клетки были получены параметры, характеризующие нейрон электрофизиологически: мембранный потенциал клетки в покое, входное сопротивление клетки, длительность ПД на уровне 50% реполяризации, частоту ПД при разной интенсивности деполяризующего стимула и т.д. Следует отметить, что можно использовать для анализа гораздо большее число электрофизиологических параметров. Важно при этом учитывать, что, внесение нового параметра требует записи нового протокола, что, соответственно, отражается на временном аспекте эксперимента. В целом для дальнейшего успешного молекулярно-биологического анализа продолжительность электрофизиологической записи клетки не должна превышать 15 мин. Для обработки электрофизиологических параметров возможно применение программы Mini Analysis Programm (Synaptosoft; Inc), в результате которого можно существенно сократить время, потраченное на обработку данных.
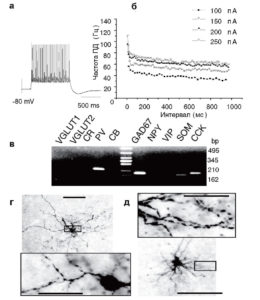
Следующий шаг: каждая клетка была охарактеризована молекулярно-биологически по схеме, рассмотренной выше. В качестве клеточных маркеров было выбрано 10 генов: везикулярные переносчики глутамата 1-го и 2-го типа, глутаматдекарбоксилаза 1, кальцийсвязывающие белки (кальбиндин, парвальбумин, кальретинин) и нейропептиды, известные как маркеры определенных классов интернейронов в миндалине (соматостатин, нейропептид У, холецистокинин и вазоинтестинальный пептид). В результате все данные были сведены в таблицу с множеством электрофизиологических параметров и экспрессией клеточных маркеров. Экспрессию генов в данной модели оценивали качественно: если клетка показывала на гельэлектрофорезе сигнал, соответствующий данному гену, то клетку считали положительной и присваивали ей значение экспрессии данного гена, равное 1.
Если сигнала не было, то экспрессию гена оценивали как нулевую. Решить вопрос об адекватной обработке полученного массива данных помог метод иерархического кластерного анализа, который был впервые также применен для анализа разных типов нейронов коры крысы6. Иерархический кластерный анализ позволяет получить древовидную диаграмму, где отдельные объекты объединены между собой в группы (кластеры). Метод древовидной кластеризации используют при формировании кластеров расстояния между объектами в одномерном или многомерном пространстве. Одним из распространенных параметров, отражающих расстояние, является Евклидово расстояние, которое представляет собой геометрическое расстояние в многомерном пространстве, или квадрат Евклидова расстояния, применяемый для того, чтобы придать больше веса объектам, удаленным друг от друга. Следующий этап – выбор правила объединения или связи. В рассматриваемом в данной главе примере был использован метод Варда, основанный на дисперсионном анализе для оценки расстояния между кластерами.
Footnotes
- Blanton M.G., Lo T.K., Kriegstein A.R. Whole-cell recording from neurons in slices of reptilian and mammalian cerebral cortex // J. Neurosci. Meth. – 1989. – Vol. 30. – P. 203-210.
- Edwards F.A., Konnerth A., Sakmann B., Takahashi T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system // Pflugers Arch. – 1989. – Vol. 414 (5). – P. 600-612.
- Tamamaki N., Yanagawa Y., Tomioka R. et al. Green fluorescent protein expression and colocalization with calretinin, parvalbumin, and somatostatin in the GAD67-GFP knock-in mouse // J. Comp. Neurol. – 2003. – Vol. 467 (1). – P. 60-79.
- Lambolez B., Audinat E., Bochet P. et al. AMPA receptor subunits expressed by single Purkinje cells // Neuron. – 1992. – Vol. 9 (2). – P. 247-258.
- Sosulina L., Meis S., Seifert G. et al. Classification of projection neurons and interneurons in the rat lateral amygdala based upon cluster analysis // Mol. Cell Neurosci. – 2006. – Vol. 33 (1). – P. 57-67.
- Cauli B., Audinat E., Lambolez B., Angulo M.C. et al. Molecular and physi-ological diversity of cortical nonpyramidal cells // J. Neurosci. – 1997. – Vol. 17 (10). – P. 3894-3906.