Микроэлектродные исследования клеток и тканей – классический метод регистрации биоэлектрической активности возбудимых тканей при помощи микроэлектродов, которые погружаются в глубь ткани без ее существенного повреждения.
История
В основе микроэлектродных исследований возбудимых тканей лежит работа G. Ling и R.W. Gerard, которые в 1949 г. использовали микроэлектроды для измерения потенциала покоя мышечных клеток лягушки1. Однако подлинный расцвет микроэлектродного метода регистрации биопотенциалов наступил после выхода работ W.L. Nastuk и A.L. Hodgkin, зарегистрировавших потенциалы действия2, и работ P. Fatt и B. Katz, применивших микроэлектроды не только для регистрации биоэлектрических параметров клеток, но и для внутриклеточной поляризации мембран3. Еще один вариант использования микроэлектродов был предложен W.L. Nastuk, который апплицировал ацетилхолин на концевую пластинку мышечной клетки, тем самым вызывая ее возбуждение4.
Реализация в России
Микроэлектродный метод регистрации биопотенциалов еще 25 лет назад использовали в большинстве лабораторий нашей страны56 и изучали в рамках студенческого практикума во многих университетах на кафедре нормальной физиологии. Однако с 2000 по 2020 год этот метод в России практически потерян, и лишь в нескольких лабораториях имеются специалисты и установки для его реализации. Микроэлектродный метод регистрации биопотенциалов клеток и их межклеточного взаимодействия в тканях, с одной стороны, достаточно прост. С другой стороны, он требует определенных теоретических знаний и экспериментальных навыков.
Техника исследования
Различают три основных способа микроэлектродного отведения сигналов:
- отведение от группы клеток (фокальное внеклеточное отведение);
- отведение от отдельной клетки при расположении кончика микроэлектрода возле нее (единичное внеклеточное отведение);
- внутриклеточное отведение
Предложено 3 способа внутриклеточного использования микроэлектродов, которые дошли до настоящих дней в той или иной технической модификации.
- Во-первых, это внутриклеточная регистрация с помощью микроэлектрода биоэлектрических параметров мембран клеток.
- Во-вторых, это поляризация через микроэлектрод мембран клеток электрическим током.
- В-третьих, это подача через микроэлектрод ионов или биологически активных соединений, причем метод подачи веществ на поверхность мембраны клетки мы далее будем называть аппликацией, а метод введения веществ внутрь клетки – ионофорезом.
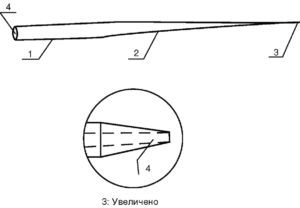
Для электрофизиологических исследований применяется стеклянный микроэлектрод или микропипетка, форма которой представлена на рис. 1. Такая микропипетка состоит из цилиндрической, сужающейся и колющей части (1, 2, 3 на рис. 1). В центре микропипетки имеется сквозной продольный канал (4 на рис.1), диаметр которого зависит от параметров стеклянной заготовки. Стеклянную микропипетку можно назвать микроэлектродом после заполнения ее сквозного продольного канала электролитом и образования контакта (тем или иным способом) электролита с электронно-измерительной схемой.
➥ Более подробно читайте: Patch clamp метод
Электрофизиологические основы регистрации биопотенциалов
Во всех случаях микроэлектродного отведения источником биоэлектрических потенциалов является поверхностная мембрана возбудимой клетки с существующей на ней трансмембранной разностью потенциалов, создаваемой неравномерным распределением положительно и отрицательно заряженных ионов между плазмой клетки и внеклеточной средой.
➥ Более подробно читайте: Биопотенциалы головного мозга
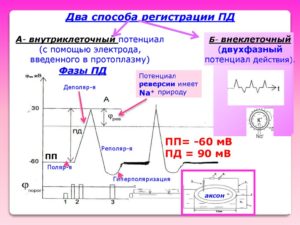
При внеклеточном отведении наличие разности потенциалов может быть обнаружено только в том случае, когда ее величина в определенном участке клетки будет изменена под действием факторов, меняющих ионную проницаемость мембраны. При этом появляются кольцевые электрические (ионные) токи между покоящимся и активированным участком клетки. В качестве индифферентного (т.е. относительного) используется электрод большой площади, расположенный на удалении (напр., на поверхности ткани); такой электрод можно рассматривать как имеющий постоянный нулевой потенциал. Соответственно микроэлектрод, расположенный в области выхода токов из клетки (область «источника» тока, англ. source), будет регистрировать положительный потенциал по отношению к относительному электроду, а микроэлектрод, расположенный в области их входа (области «стока» тока, англ. sink), — отрицательный потенциал. Чем ближе подведение микроэлектрода к источнику тока, тем больше регистрируемая разность потенциалов. Положение же относительного электрода при условии, что он удален в область, где плотность проходящих токов практически оказывается ничтожной, не сказывается на результатах отведения. Амплитуда отводимых колебаний будет зависеть не только от количества возбужденных клеток и величины участка, охваченного соответствующим электрическим изменением, но и от расстояния от источника биопотенциалов до кончика микроэлектрода.
При внутриклеточном отведении источник ЭДС (т.е. поверхностная мембрана клетки) оказывается между микро- и относительным электродом, что приводит к отведению постоянной разности потенциалов в несколько десятков милливольт. Скачкообразное появление такой разности является основным критерием проникновения кончика микроэлектрода внутрь клетки. Появление активной реакции в отводимой клетке регистрируется как изменение постоянной разности потенциалов в сторону ее уменьшения или извращения (явление деполяризации) либо увеличения (гиперполяризация).
Цели применения
Прежде всего необходимо отметить, что микроэлектродный метод регистрации биопотенциалов позволяет:
- регистрировать разность биопотенциалов между внутренней и наружной средой клетки, т.е. потенциал покоя;
- регистрировать спонтанно возникающие потенциалы действия (ПД);
- стимулировать клетку электрическим током различной величины, что дает возможность изучать пассивный электротонический потенциал, локальный ответ и вызванный ПД; также с помощью этого метода возможно стимулировать клетку длительным электрическим током положительной и отрицательной полярности, что позволяет моделировать, например, синаптические влияния;
- вводить в клетку ионы и некоторые низкомолекулярные соединения;
- изучать межклеточное электротоническое химическое синаптическое взаимодействие.
Метод можно применять на любых клетках и тканях, однако он наиболее эффективен в отношении нервных клеток, частично применим к миокардиальным клеткам (без учета возможности внутриклеточной стимуляции) и может быть использован для изучения мембранных потенциалов многих других клеток.
Фокальное внеклеточное микроэлектродное отведение находит применение при изучении распространения возбуждения в пределах отдельных мозговых структур. Особенно успешным оно является в случае правильной ориентации соответствующих нейронных структур (напр., слоистой), поскольку создаваемые в этом случае отдельными клетками электрические поля суммируются и соответственно усиливаются. Поэтому при фокальном отведении могут быть зарегистрированы даже слабые эффекты, создаваемые синаптическими влияниями. Особенно широко фокальное отведение используется при исследовании коры больших полушарий головного мозга, позволяя в определенной степени отделить процессы, протекающие в дендритах пирамидальных нейронов (образующих верхние слои серого вещества), от процессов, протекающих в их телах. В стволе головного мозга и в спинном мозге также имеется относительно правильная ориентация мотонейронов и их аксонов, поэтому фокальное отведение было использовано здесь для установления особенностей распространения процесса возбуждения в различных частях клетки (миелинизированная и немиелинизированная части аксона, сома и отчасти дендриты). Большое значение метод фокального отведения имел при разработке подробных карт распределения потенциалов по определенному сечению мозга в различные моменты времени после поступления в мозг афферентной сигнализации. Такие карты позволяют сделать ряд выводов о распространении процессов возбуждения в пределах данной области мозга.
Единичное внеклеточное микроэлектродное отведение нашло применение при отведении биоэлектрических потенциалов от мышц, некоторых рецепторов (сетчатка глаза) и т. д. Внеклеточное отведение активности отдельных нейронов мозга широко производится сейчас от всех его участков как в эксперименте, так и в клинических условиях во время нейрохирургических операций. Основным критерием отведения активности отдельной клетки является возникновение потенциалов действия постоянной величины, связанное с подчинением распространяющихся процессов в клетке правилу «все или ничего». Особенно успешным такое отведение является, естественно, в случае ритмически-активных клеток, что создает удобные условия для сравнения амплитуд последовательных разрядов. Внеклеточное отведение с успехом используется для исследования механизма процесса конвергенции возбуждающих и тормозящих синаптических влияний, изменений деятельности нейронов в различных физиологических условиях, под действием фармакологических факторов и т. д. Внеклеточное отведение синаптических потенциалов отдельных клеток значительно менее эффективно, чем отведение импульсной активности, поскольку создаваемые ими электрические поля во много раз слабее полей, создаваемых потенциалами действия. Кроме того, практически невозможно достоверно подтвердить факт отведения активности от одной клетки, поскольку синаптические потенциалы не подчиняются правилу «все или ничего» и величина их является весьма вариабельной в одном и том же нейроне. Внеклеточное отведение потенциалов отдельных нейронов является пока единственно возможным методом тонкого анализа деятельности нервной системы. При особых методах погружения микроэлектродов возможно достаточно длительное внеклеточное отведение на животных без наркоза при сохраненной высшей нервной деятельности и даже в условиях свободного поведения.
Внутриклеточное отведение — это основной метод изучения внутренних механизмов функционирования возбудимых клеток, в т. ч. ионных механизмов генерации потенциала действия, возбуждающих и тормозящих постсинаптических потенциалов и т. д. Именно с помощью внутриклеточного микроэлектродного отведения была впервые показана связь постсинаптического торможения с гиперполяризацией постсинаптической мембраны. Широкое применение внутриклеточное отведение нашло при изучении деятельности рецепторов, в частности при изучении происхождения и функционального значения генераторных потенциалов.
Читайте также
- Электрофизиология головного мозга
- Calcium imaging: метод изучения активности нейронов
- Измерение внутриклеточной концентрации свободных ионов Са , Nа и Н
- Электроэнцефалография (ЭЭГ)
Footnotes
- Ling G., Gerard R.W. The normal membrane potential of frog sartorius fibers // J. Cell Physiol. – 1949. – Vol. 34. – P. 383-396.
- Nastuk W.L, Hodgkin A.L. The electrical activity of single muscle fibres //Cell Comp. Physiol. – 1950. – Vol. 35. – P. 39-73.
- Fatt P., Katz B. An analysis of the end-plate potential recorded with an intracellular electrode // J. Physiol. – 1951. – Vol. 115. – P. 320-370.
- Nastuk W.L. Membrane potential changes at a single muscle end-plate produced by transitory application of acetylcholine with an electrically controlled microjet // Fend. Fend. Am. Socs. Exp. Biol. – 1953. – Vol. 12. – P. 102.
- Камкин А.Г., Киселева И.С. Техническое обеспечение микроэлектродного исследования клеток. – М.: Мосгорпечать, 1989. – 174 с.
- Purves R.D. Microelectrode Methods for Intracellular Recording and Ionophoresis / A Subsidiary of Harcourt Brace Jovanovich, Publishers. – Academic Press, London, №4, Toronto, Sydney San Francisco, 1981