Долгое время после того, как метод patch-clamp был описан впервые, его применение для изучения свойств нервных клеток было весьма ограничено, так как не представлялось возможным получать неповрежденные нейроны. В связи с этим электрофизиологические эксперименты проводили на первичных культурах нейрональных и глиальных клеток или на клетках, изолированных из ткани путем ее обработки ферментами. Проблема изолирования клеток и получения качественной электрофизиологической записи была решена в конце 1980-х годов с развитием экспериментального подхода, позволяющего применять метод patch-clamp на срезах мозга12.
Преимущество использования срезов мозга для patch-clamp экспериментов и огромный успех данного метода состоят в том, что он позволяет изучать клетки в условиях практически интактной нервной системы при сохранении синаптических контактов. Применение patch-clamp на срезах мозга не требует предварительной обработки ферментами, которая может привести к изменению свойств мембран клеток, и, кроме того, позволяет изменять внутриклеточную среду при использовании пипеточных растворов, различающихся по составу, производя записи активности отдельных нейронов в условиях, максимально приближенных к физиологическим. Конфигурация whole-cell позволяет инъецировать в клетку красители разной природы, при помощи которых клетку можно охарактеризовать морфологически с применением методов иммуногистохимии. Введение флуоресцентных красителей и использование конфокальной микроскопии позволяют наблюдать за изменением структуры и функции отдельных синаптических окончаний на живых срезах мозга. Кроме того, технология срезов мозга является перспективным методом для изучения синаптической передачи. Использование тетродотоксина на срезе мозга в конфигурации whole-cell позволяет регистрировать спонтанные миниатюрные синаптические токи (мини). Тетродотоксин при этом специфично блокирует Na+-проводимость, но не влияет ни на проводимость К+, ни на другие важные этапы в синаптической передаче: секрецию нейромедиатора из пресинаптической мембраны, образование нейромедиатора и ионную проницаемость постсинаптической мембраны.
Для установления характера синаптической передачи помимо отведения спонтанной активности возможно регистрировать вызванные потенциалы, стимулируя при этом отдельный нейрон (аксон) или целую группу аксонов3. В последнее десятилетие спектр применения patch-clamp на срезах мозга дополнительно расширился в связи с внедрением методики определения характера экспрессии генов на одиночном нейроне, что позволило охарактеризовать отдельные клетки мозга физиологически и молекулярнобиологически. Вместе с тем, какое применение patch-clamp бы не было выбрано экспериментатором, получение качественных долгоживущих срезов – первоочередная задача. На методике приготовления срезов и особенностях их хранения мы остановимся подробнее.
Приготовление срезов мозга
Для приготовления срезов мозга применяют вибратомы. Качество полученных срезов зависит напрямую от качества вибратома и его характеристик. Надежные и удобные в использовании вибратомы производит, например, фирма Vibratome (St. Louis, USA).

1 - лезвие бритвы; 2 - изолированный участок мозга, наклеенный на чашку Петри; 3 - охлажденный раствор для приготовления срезов; 4 - дистиллированная вода с кусочками льда; 5 - готовый срез мозга; 6 - наклеенный блок агара
Однако для всех вибратомов существуют общие правила эксплуатации. Для приготовления долгоживущих срезов мозга предпочтительно использование стерильных инструментов. Лезвие не должно содержать неоднородностей (при необходимости применять бинокуляр для контроля). Для получения долгоживущих срезов мозг должен быть очень быстро и качественно препарирован и немедленно помещен в охлажденный раствор Рингера, насыщенный карбогеном. Время от момента декапитации животного до помещения мозга в раствор является критическим, оно не должно превышать 1 мин. Желательно, чтобы раствор при этом содержал небольшое количество кристаллов льда. Для приготовления срезов мозга может быть использован насыщенный кислородом раствор следующего состава (мМ): KCl – 2,4; MgSO4 (сульфат магния) – 10; CaCl2 (хлорид кальция) – 0,5; пиперазин-1,4-бис (2-этансульфоновая) кислота (PIPES) – 20; глюкоза – 10; сахароза – 195 (pH=7,35). Перед началом нарезки участок мозга, содержащий представляющий интерес ареал, необходимо вырезать при помощи скальпеля на охлажденном металлическом блоке. Затем подготовленный участок мозга фиксируют клеем (Суперглю-гель) на металлическом или тефлоновом блоке вибратома для нарезки. Зафиксировать мозг для нарезки также возможно в чашке Петри с предварительно наклеенными блоками агара, выполняющими функцию стабилизации (рис. 1). Поверхность, на которую приклеивают выбранный участок, необходимо сохранять сухой, так как в противном случае мозг будет зафиксирован недостаточно стабильно, что может привести к перемещению ткани и получению срезов непостоянной толщины.
Толщина среза (регулируется вручную) – важный параметр, который необходимо выбрать перед началом серии экспериментов. Толщина используемых срезов зависит от характера эксперимента, а также от возраста животного. Чем моложе экспериментальное животное, тем легче увидеть отдельные клетки. Кроме того, следует принимать во внимание, что различные клетки переживают условия эксперимента неодинаково. Обычно крупные нейроны более чувствительны по сравнению с мелкими. Возможным объяснением может служить тот факт, что у крупных клеток с разветвленной сетью дендритов повредить клеточные отростки при приготовлении срезов гораздо легче. Помимо этого, клетки различаются по реакции на недостаток кислорода. Оптимальная толщина срезов для дальнейшего исследования методом инфракрасной микроскопии (подробное описание метода представлено в разделе «Использование инфракрасного света для идентификации клеток на срезах мозга») составляет 250-300 мкм, что применимо в основном для приготовления срезов мозга молодых животных (например, крысят до 3-недельного возраста). Для взрослых животных возможно использование более тонких срезов (толщиной до 180 мкм). Толщина срезов мозга взрослого животного не должна превышать 400 мкм, так как в противном случае доступ кислорода к внутрилежащим тканям будет затруднен. Максимальная толщина срезов молодого животного может достигать 600 мкм, так как ткани более рыхлые, и кислород может легче проникать вглубь.
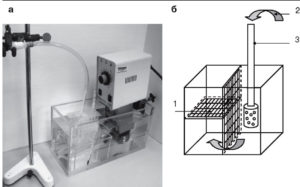
состоящая из термостата с регулировкой температуры, инкубационной камеры и системы подачи карбогена (а). Простейшая инкубационная камера для жизнеобеспечения срезов (б). Камера изготовлена из плексигласового сосуда и разборных пластинок (внутренние элементы камеры). Ее заполняют раствором, например раствором Кребса. Срезы выкладывают на сеточку (1). Подачу карбогена (2) осуществляют при помощи аквариумного аэратора (3)
После приготовления срезы помещают в камеру, где инкубируются сначала 20-60 мин при температуре 33-35 °С, затем – при комнатной температуре, до тех пор пока не будут использованы для электрофизиологического эксперимента. Возможный вариант камеры для сохранения срезов представлен на рис. 2. Обычно камера представляет собой сосуд из плексигласа, заполненный раствором Рингера, и состоит из двух отсеков. Один отсек обеспечивает оксигенацию раствора при помощи помещенного внутрь аквариумного аэратора, доставляющего карбоген. Второй отсек камеры содержит сеточку, на которую выкладывают приготовленные срезы. При этом важно избежать образования пузырей и их контакта со срезами, а также перемещения срезов, приводящего к повреждению тканей. Правильно приготовленные срезы сохраняют активность до 12-15 ч, однако оптимальное время, в течение которого лучше использовать срезы, составляет 6-8 ч.
Перед началом электрофизиологического опыта срезы при помощи пастеровской пипетки должны быть перенесены в рабочую камеру для измерения и зафиксированы в ней при помощи расплющенной подковообразной платиновой проволочки с натянутыми на нее тонкими капроновыми нитями. Подобная фиксация среза в рабочей камере необходима для того, чтобы он сохранял неподвижность во время прохождения раствора через рабочую камеру. Для подачи раствора в рабочую камеру применяют систему подачи раствора с перистальтическим насосом. Скорость протока при этом обычно составляет 1-3 мл/мин, что позволяет обеспечивать жизнеспособность среза, но не приводит к перемещению объекта.
➥ Читайте также: Техника patch clamp на срезах мозга
Footnotes
- Blanton M.G., Lo T.K., Kriegstein A.R. Whole-cell recording from neurons in slices of reptilian and mammalian cerebral cortex // J. Neurosci. Meth. – 1989. – Vol. 30. – P. 203-210.
- Edwards F.A., Konnerth A., Sakmann B., Takahashi T. A thin slice prepara-tion for patch clamp recordings from neurones of the mammalian central nervous system // Pflugers Arch. – 1989. – Vol. 414 (5). – P. 600-612.
- Edwards F.A., Konnerth A., Sakmann B. Quantal analysis of inhibitory synaptic transmission in the dentate gyrus of rat hippocampal slices: a patch-clamp study // J. Physiol. – 1990. – Vol. 430. – P. 213-249.