Планарный микроэлектродный массив (англ. planar microelectrode array, pMEA) – представляет собой плоскую матрицу с расположенными на поверхности микроэлектродами (от десятков до тысяч), при помощи которой осуществляют внеклеточную регистрацию биоэлектрической активности нейронов в условиях in vitro (используются клеточные культуры или диссоциированные нейроны).
История
Разработка pMEA началась более 30 лет назад1 и продолжается с тех пор.2 Веха была достигнута, когда Pine в 1980 году впервые представил записи, полученные из культур диссоциированных нейронов (верхних шейных ганглиев у новорожденных крыс).3 Что делает работу Pine такой важной, так это то, что в ней сообщается об одновременной внутри- и внеклеточной регистрации нейрональной активности, что доказывает полезность pMEA для мониторинга нейрональных реакций. С тех пор различные группы разработали свои собственные плоские микроэлектродные матрицы456 и использовали их в сочетании с различными типами нейрональных клеточных культур.789 Наконец, технология pMEA была улучшена, когда стала возможной стимуляция нейронов.10 С тех пор исследование нейронных сетей стало важным инструментом как в фармацевтических экспериментах,11 так и в фундаментальных исследованиях.1213
Строение и виды планарных массивов
Как правило, микроэлектроды (точнее токосъемные поверхности) сделаны из золота и часто покрыты черной платиной,1415 чтобы снизить их сопротивление. Другие материалы, такие как нитрид титана, который обладает высокой нанопористостью, также используется для создания микроэлектродов. Межкомпонентные соединения часто изготавливаются из оксида индия и олова (Indium Tin Oxide, ITO), за счет своей прозрачности они обеспечивают возможность прямого наблюдения за клетками с помощью инвертированного микроскопа.16
Слой изолирующего материала должен соответствовать необходимым требованиям биосовместимости и устойчивости, особенно для долгосрочного изучения культур. До настоящего времени для этой цели было успешно использовано несколько материалов, включая SiO₂, Si₃N₄, полимеры, такие как полиимид, силиконовая смола,17 полиакриламид или SU-8.18 Эти материалы должны быть обработаны материалами, которые способствуют адгезии клеток. Наиболее широко используемыми молекулами являются полилизин, ламинин и полиэтиленимин.1920
Виды планарных мультиэлектродных массивов
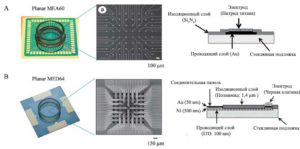
Мультиоэлектродный массив (англ. multi-electrode array, MEA) (8 × 8 массивов из 60 микроэлектродов) состоит из 60 микроэлектродов каждый диаметром 30 мкм, с межэлектродным расстоянием 200 мкм, размещенных на стеклянной подложке. Электроды сделаны из нитрида титана и соединенны с ленточными проводниками, состоящими из золотого проводящего слоя (Au). Изолирующее покрытие – нитрид кремния.
Мультиэлектродная ванночка (англ. multi-electrode dish, MED) (8 × 8 массивов из 64 микроэлектродов).2122 состоит из 64 микроэлектродов размером 50х50 мкм и межэлектродным расстоянием 100 мкм, расположенных на стеклянной подложке. Квадратные микроэлектроды изготовлены из черной платины + золото (Au) + никель (Ni) и соединены с ленточными проводниками из прозрачного оксида индия и олова. Изолирующее покрытие – полиакриламид.
Недавно были разработаны планарные массивы микроэлектродов высокой плотности (HD-MEA), основанные на технологии комплементарных металлоксидных полупроводников (CMOS), которые могут иметь до нескольких десятков тысяч электродов с клеточным и субклеточным пространственным разрешением.2324
Применение

Электроды измеряют потенциалы внеклеточного поля, генерируемые потенциалом действия, и могут также использоваться для стимуляции нервной клетки. pМEА обеспечивают неинвазивные, долгосрочные измерения для изучения нейронной активности.2526
➥Более подробно: Микроэлектродный метод измерения мембранного потенциала
Планарные МЕА широко используются для регистрации различных видов препаратов, начиная от культивируемых нейронов и органотипических срезов мозга и заканчивая диссоциированными срезами мозга. Последнее используется в исследованиях синаптической пластичности из-за следующих преимуществ:
- Синаптические структуры в локальных областях мозга остаются относительно интактными;
- Избегают модификации ткани или аберрантные связи, вызванные культурой;
- Записи могут быть выполнены на тонких срезах мозга животных c моделированными заболеваниями головного мозга;
- Записи МEА могут сочетаться с поведенческими и молекулярно-клеточными исследованиями;
- Процедура экономит время.
Однако использование плоских МEА в диссоциированных срезах мозга может привести к менее стабильной записи из-за слоя мертвых клеток на поверхности среза, связанного с повреждением клеток во время изготовления среза, что приводит к низкому отношению сигнал/шум. Так называемый «слой мертвых клеток» обозначает границу среза (~ 50 мкм в глубину), на которой немногие клетки остаются активными после травмы и отека. Это формирует электрически пассивный слой, создающий шунт между pМEА и активными клетками внутри среза, что приводит к низкоамплитудному сигналу. Таким образом, уменьшение расстояния между записывающими электродами и активными клетками является хорошим способом получения высокоамплитудных сигналов, для решения этой проблемы используют 3D-MEA.
pMEA были использованы для взаимодействия нейронных сетей с небиологическими системами в качестве контроллера. Например, с использованием MEA может быть создан нейро-компьютерный интерфейс. Диссоциированные нейроны коры крысы были интегрированы в замкнутую цепь обратной связи стимул-реакция, чтобы управлять аниматом в виртуальной среде.27
Преимущества и недостатки
В целом основные преимущества планарных массивов по сравнению с более традиционными методами, такими как patch clamp, включают следующее:28
- Допускается размещение нескольких электродов одновременно, а не по отдельности;
- Возможность установки нескольких электродов в качестве контроля и стимуляции, а других в качестве регистрирующих. Это представляет особый интерес в экспериментах со стимуляцией;
- Возможность выбирать разные отведения в массиве, что позволяет контролировать коммутацию, разрешение и выбирать зоны регистрации сигнала;
Кроме того, массивы не повреждают клетку по сравнению с patch clamp, потому что они не требуют перфорации клеточной мембраны.
К недостаткам относится то, что pMEA менее пригодны для записи и стимуляции отдельных клеток из-за их относительно низкого пространственного разрешения по сравнению с patch clamp и dynamic clamp.
Сложность формы сигналов, которые электрод pMEA может эффективно передавать в клетки ограничена.
Footnotes
- Thomas, C., Springer, P., Loeb, G., Berwald-Netter, Y.,
and Okun, L.: A miniature microelectrode array to monitor the bioelectric activity of cultured cells. Exp. Cell Res., 74, 61–66 (1972). - Potter, S.M.: Distributed processing in cultured neuronal networks. Prog. Brain Res., 130, 49–62 (2001).
- Pine, J.: Recording action potentials from cultured neurons
with extracellular microcircuit electrodes. J. Neurosci. Methods, 2, 19–31 (1980). - Novak, J. and Wheeler, B.: Recording from the aplysia abdominal ganglion with a planar microelectrode array. IEEE Trans. Biomed. Eng., 33, 196–202 (1986).
- Jimbo, Y. and Kawana, A.: Electrical stimulation and recording from cultured neurons using a planar microelectrode array. Bioelectrochem. Bioenerg., 29, 193–204 (1992).
- Cunningham, W., Mathieson, K., McEwan, F., Blue, A., McGeachy, R., McLeod, J., Morris-Ellis, C., O’Shea, V., Smith, K., Litke, A., and Rahman, M.: Fabrication of microelectrode arrays for neural measurements from retinal tissue. J. Phys. D Appl. Phys., 34, 2804–2809 (2001).
- Egert, U., Heck, D., and Aertsen, A.: Two-dimensional monitoring of spiking networks in acute brain slices. Exp. Brain Res., 142, 268–274 (2002).
- Wirth, C. and Lücher, H.-R.: Spatiotemporal evolution of excitation and inhibition in the rat barrel cortex investigated with multielectrode array. J. Neurophysiol., 91, 1635–1647 (2004).
- Hofmann, F., Guenther, E., Hämerle, H., Leibrock, C., Berezin, V., Bock, E., and Volkmer, H.: Functional reestablishment of the perforant pathway in organotypic cocultures on microelectrode arrays. Brain Res., 1071, 184– 196 (2004).
- Gross, G., Rhoades, B., Reust, D., and Schwalm, F.: Stimulation of mmonolayer networks in culture through thin-film indium-tin oxide recording electrodes. J. Neurosci. Methods, 50, 131–143 (1993).
- Gholmieh, G., Courellis, S., Fakheri, S., Cheung, E., Marmarelis, V., Baudry, M., and Berger, T.: Detection and classification of neurotoxins using a novel short-term plasticity quantification method. Biosens. Bioelectron., 18, 1467–1478 (2003).
- Shahaf, G. and Marom, S.: Learning in networks of cortical neurons. J. Neurosci., 21, 8782–8788 (2001).
- Eytan, D., Brenner, N., and Marom, S.: Selective adaptation in networks of cortical neurons. J. Neurosci., 23, 9349–9356 (2003).
- Prasad, S., Yang, M., Zhang, X., Ozkan, C. S., and Ozkan, M.: Neurons as sensors: individual and cascaded chemical sensing. Biosens. Bioelectron., 19, 1599–1610 (2004).
- Bucher, V., Graf, M., Stelzle, M., and Nisch, W.: Low impedance thin-film polycrystalline silicon microelectrodes for extracellular stimulation and recording. Biosens. Bioelectron., 14, 639–649 (1999).
- Ziegler, C.: Cell-based biosensors. Fresenius J. Anal. Chem., 366, 552–559 (2000).
- Gross, G. W. and Kowalski, J. M.: Origin of activity patterns in self-organizing neuronal networks in vitro. J. Intell. Mater. Syst. Struct., 10, 558–564 (2001)
- Heuschkel, M., Guérin, L., Buisson, B., Bertrand, D., and Renaud, P.: Buried microchannels in photopolymer for delivering of solutions to neurons in a network. Sens. Actuators B, 48, 356–361 (1998).
- Chang, J. C., Brewer, G. J., and Wheeler, B. C.: Microelectrode array recordings of patterned hippocampal neurons for four weeks. Biomed. Microdev., 2, 245–253 (2000)
- James, C. D., Spence, A. J. H., Dowell-Mesfin, N. M., Rifat, J. H., Smith, K. L., Craighead, H. G., Isaacson, M. S., Shain, W., and Turner, J. N.: Extracellular recordings from patterned neuronal networks using planar microelectrode arrays. IEEE Trans. Biomed. Eng., 51, 1640–1648 (2004).
- Egert U, -Schlosshauer B, Fennrich S, Nisch W, Fejtl M, Knott T, et al. A novel organotypic long-term culture of the rat hippocampus on substrate-integrated multielectrode arrays. Brain Res Brain Res Protoc 1998, 2: 229–242.
- Oka H, Shimono K, Ogawa R, Sugihara H, Taketani M. A new planar multielectrode array for extracellular recording: application to hippocampal acute slice. J Neurosci Methods 1999, 93: 61–67
- Frey, U. et al. Switch-Matrix-Based High-Density Microelectrode Array in CMOS Technology. Solid-State Circuits, IEEE J. 45, 467–482, doi:10.1109/JSSC.2009.2035196 (2010).
- Ballini, M. et al. A 1024-Channel CMOS Microelectrode Array With 26,400 Electrodes for Recording and Stimulation of Electrogenic Cells In Vitro. IEEE J. Solid-State Circuits 49, 1–15, doi:10.1109/JSSC.2014.2359219 (2014).
- Obien M.E., Deligkaris K., Bullmann T., Bakkum D.J., Frey U. Revealing Neuronal Function Through Microelectrode Array Recordings. Front. Neurosci. 2015;8:1–30. doi: 10.3389/fnins.2014.00423. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Spira M.E., Hai A. Multi-Electrode Array Technologies for Neuroscience and Cardiology. Nat. Nanotechnol. 2013;8:83–94. doi: 10.1038/nnano.2012.265. [PubMed] [CrossRef] [Google Scholar]
- DeMarse TB, Wagenaar DA, Blau AW, Potter SM. 2001. The Neurally Controlled Animat: Biological Brains Acting with Simulated Bodies. Autonomous Robots 11: 305-10.
- Whitson J, Kubota D, Shimono K, Jia Y, Taketani M. Multi-Electrode Arrays: Enhancing Traditional Methods and Enabling Network Physiology. In: Baudry M, Taketani M, eds. Advances in Network Electrophysiology Using Multi-Electrode Arrays. New York: Spring Press; 2006: 38-68