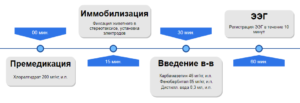
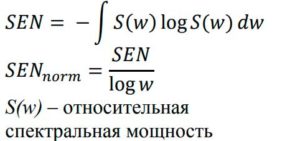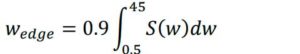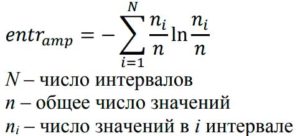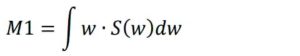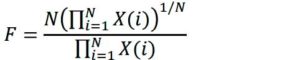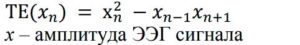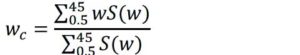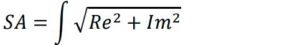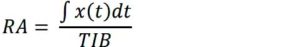Footnotes
- https://www.karger.com/Article/FullText/343478
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6157576/
- https://www.frontiersin.org/articles/10.3389/fnhum.2015.00708/full
- https://www.researchgate.net/publication/226608201_Model_Comparison_for_the_Detection_of_EEG_Arousals_in_Sleep_Apnea_Patients
- Muhammad, B., Jusof, M. F. M., Shapiai, M. I., Adam, A., Yusof, Z. M., Azmi, K. Z. M., ... & Mokhtar, N. (2018, May). Feature selection using binary simulated Kalman filter for peak classification of EEG signals. In 2018 8th International Conference on Intelligent Systems, Modelling and Simulation (ISMS) (pp. 1-6). IEEE.
- Fell J. et al. Discrimination of sleep stages: a comparison betweenspectral and nonlinear EEG measures //Electroencephalography and clinicalNeurophysiology. – 1996. – Т. 98. – №. 5. – С. 401-410.
- Löfhede J. et al. Automatic classification of background EEG activity inhealthy and sick neonates //Journal of neural engineering. – 2010. – Т. 7. – №. 1. – С.016007.
- Inouye T. et al. Quantification of EEG irregularity by use of the entropyof the power spectrum //Electroencephalography and clinical neurophysiology. –1991. – Т. 79. – №. 3. – С. 204-210.
- Fell J. et al. Discrimination of sleep stages: a comparison between spectral and nonlinear EEG measures //Electroencephalography and clinical Neurophysiology. – 1996. – Т. 98. – №. 5. – С. 401-410.
- Löfhede J. et al. Automatic classification of background EEG activity in healthy and sick neonates //Journal of neural engineering. – 2010. – Т. 7. – №. 1. – С. 016007.
- Fell J. et al. Discrimination of sleep stages: a comparison between spectral and nonlinear EEG measures //Electroencephalography and clinical Neurophysiology. – 1996. – Т. 98. – №. 5. – С. 401-410.
- Zoubek L. et al. Feature selection for sleep/wake stages classification using data driven methods //Biomedical Signal Processing and Control. – 2007. – Т. 2. – №. 3. – С. 171-179.
- Fell J. et al. Discrimination of sleep stages: a comparison between spectral and nonlinear EEG measures //Electroencephalography and clinical Neurophysiology. – 1996. – Т. 98. – №. 5. – С. 401-410.
- Löfhede J. et al. Automatic classification of background EEG activity in healthy and sick neonates //Journal of neural engineering. – 2010. – Т. 7. – №. 1. – С. 016007.
- Cvetkovic D., Cosic I. Sleep onset estimator: evaluation of parameters //Engineering in Medicine and Biology Society, 2008. EMBS 2008. 30th Annual International Conference of the IEEE. – IEEE, 2008. – С. 3860-3863.
- Löfhede J. et al. Automatic classification of background EEG activity in healthy and sick neonates //Journal of neural engineering. – 2010. – Т. 7. – №. 1. – С. 016007.
- Álvarez-Estévez D., Moret-Bonillo V. Model comparison for the detection of EEG arousals in sleep apnea patients //International Work-Conference on Artificial Neural Networks. – Springer, Berlin, Heidelberg, 2009. – С. 997-1004.
- Kaiser J. F. Some useful properties of Teager's energy operators //Acoustics, Speech, and Signal Processing, 1993. ICASSP-93., 1993 IEEE International Conference on. – IEEE, 1993. – Т. 3. – С. 149-152.
- Ahmed B., Redissi A., Tafreshi R. An automatic sleep spindle detector based on wavelets and the teager energy operator //Engineering in Medicine and Biology Society, 2009. EMBC 2009. Annual International Conference of the IEEE. –IEEE, 2009. – С. 2596-2599.
- Van Hese P. et al. Automatic detection of sleep stages using the EEG //Engineering in Medicine and Biology Society, 2001. Proceedings of the 23rd Annual International Conference of the IEEE. – IEEE, 2001. – Т. 2. – С. 1944-1947.
- Zoubek L. et al. Feature selection for sleep/wake stages classification using data driven methods //Biomedical Signal Processing and Control. – 2007. – Т.2. – №. 3. – С. 171-179.
- Estrada E. et al. EEG feature extraction for classification of sleep stages //Engineering in Medicine and Biology Society, 2004. IEMBS'04. 26th Annual International Conference of the IEEE. – IEEE, 2004. – Т. 1. – С. 196-199.
- Huupponen E. et al. Automatic analysis of electro-encephalogram sleep spindle frequency throughout the night //Medical and Biological Engineering and Computing. – 2003. – Т. 41. – №. 6. – С. 727-732.
- Huupponen E. et al. Comparison of fuzzy reasoning and autoassociative MLP in sleep spindle detection //Signal Processing Conference, 2000 10th European.– IEEE, 2000. – С. 1-4.
- Agarwal R., Gotman J. Computer-assisted sleep staging //IEEE Transactions on Biomedical Engineering. – 2001. – Т. 48. – №. 12. – С. 1412-1423.
- Van Hese P. et al. Automatic detection of sleep stages using the EEG //Engineering in Medicine and Biology Society, 2001. Proceedings of the 23rd Annual International Conference of the IEEE. – IEEE, 2001. – Т. 2. – С. 1944-1947.
- Estrada E. et al. EEG feature extraction for classification of sleep stages //Engineering in Medicine and Biology Society, 2004. IEMBS'04. 26th Annual International Conference of the IEEE. – IEEE, 2004. – Т. 1. – С. 196-199.
- Tang W. C. et al. Harmonic parameters with HHT and wavelet transform for automatic sleep stages scoring //REM. – 2007. – Т. 365. – С. 8-6.
- Hjorth B. EEG analysis based on time domain properties //Electroencephalography and clinical neurophysiology. – 1970. – Т. 29. – №. 3. – С.306-310.
- Van Hese P. et al. Automatic detection of sleep stages using the EEG //Engineering in Medicine and Biology Society, 2001. Proceedings of the 23rd Annual International Conference of the IEEE. – IEEE, 2001. – Т. 2. – С. 1944-1947.
- GEERING B. A. et al. Period‐amplitude analysis and power spectral analysis: a comparison based on all‐night sleep EEG recordings //Journal of sleep research. – 1993. – Т. 2. – №. 3. – С. 121-129.
- GEERING B. A. et al. Period‐amplitude analysis and power spectral analysis: a comparison based on all‐night sleep EEG recordings //Journal of sleep research. – 1993. – Т. 2. – №. 3. – С. 121-129.
- Uchida S. et al. A comparison of period amplitude analysis and FFT power spectral analysis of all-night human sleep EEG //Physiology & behavior. –1999. – Т. 67. – №. 1. – С. 121-131.
- Huupponen E. et al. Development and comparison of four sleep spindle detection methods //Artificial intelligence in medicine. – 2007. – Т. 40. – №. 3. – С.157-170.
- Huupponen E. et al. Automatic analysis of electro-encephalogram sleep spindle frequency throughout the night //Medical and Biological Engineering and Computing. – 2003. – Т. 41. – №. 6. – С. 727-732.
- Zoubek L. et al. Feature selection for sleep/wake stages classification using data driven methods //Biomedical Signal Processing and Control. – 2007. – Т.2. – №. 3. – С. 171-179.
- Zhovna I., Shallom I. D. Automatic detection and classification of sleep stages by multichannel EEG signal modeling //Engineering in Medicine and Biology Society, 2008. EMBS 2008. 30th Annual International Conference of the IEEE. –IEEE, 2008. – С. 2665-2668.
- Acır N., Güzeliş C. Automatic recognition of sleep spindles in EEG by using artificial neural networks //Expert Systems with Applications. – 2004. – Т. 27.– №. 3. – С. 451-458.