Фармако-ЭЭГ или фармакоэлектроэнцефалография (от англ. pharmaco-electroencephalography, pharmaco-EEG или P-EEG) – это смежное направление электрофизиологии и фармакологии, которое занимается изучением воздействия лекарств на центральную нервную систему посредством анализа изменений параметров электроэнцефалограммы в ответ на введение препарата.
Исследования фармако-ЭЭГ с использованием клинической ЭЭГ и количественной ЭЭГ существуют уже более семи десятилетий. Необходимость применения фармако-ЭЭГ-исследований обусловлена тем, что ее данные должны учитываться при решении дифференциально-диагностических задач, что особенно важно на ранних стадиях заболевания для выбора наиболее эффективных методов лечения и контроля проводимой терапии.
Количественная фармако-ЭЭГ (англ. quantitative pharmaco-electroencephalography, QPEEG) – это комплекс методов, применяемых для описания и количественной оценки эффектов психотропных препаратов на ЭЭГ. Количественный фармако-ЭЭГ анализ проводится с помощью статистических, математических, нейрофизиологических и электрофизиологических методов, используемых в рамках клинической и экспериментальной фармакологии, нейротоксикологии, терапевтических исследований и смежных дисциплин.
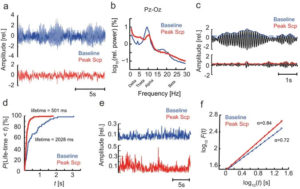
A) ЭЭГ испытуемого в исходном состоянии (синий) и после введения скополамина (красный). B) Усредненный нормализованный спектр мощности отражает эффект скополамина, а именно снижение мощности в альфа- и бета- диапазонах, повышение мощности в дельта- и тета-диапазонах частот. C) Модулированная амплитуда альфа-полосы с использованием преобразования Гильберта. Медиана амплитуды как пороговое значение для детекции альфа- вспышек. D) Распределение кумулятивной вероятности для продолжительности вспышек. Наблюдается тенденция к повышению продолжительности после введения скополамина. E) Модулированная амплитуда бета-колебанияй (13-30 Гц). F) Анализ флуктуаций с исключенным трендом.
Профили фармако-ЭЭГ различных классов лекарственных средств широко используются для оценки терапевтической эффективности медикаментозного лечения и идентификации новых веществ1234.
Фармакологический ЭЭГ-профиль представляет собой статистическую оценку реакции ЭЭГ-активности на воздействие психофармакологического средства. ЭЭГ-профиль чаще всего изображается в виде графика, по оси абсцисс которого располагаются частотные показатели ЭЭГ-диапазона (от 0 до 35 Гц), а по оси ординат – величины мощности сигнала ЭЭГ до и после введения психотропного вещества со статистическими расчетами значимости различий, однако допускаются и другие варианты представления результатов. Для построения количественного фармако-ЭЭГ-профиля обычно используют данные ЭЭГ, зарегистрированной от правой затылочной области, в которой в основном представлены все виды ритмической активности.
Основной целью применения ЭЭГ в экспериментальных и в клинических исследованиях новых веществ является поиск специфических биомаркеров для выявления лекарственно-индуцированных эффектов. Фармако-ЭЭГ позволяет классифицировать лекарственные вещества по фармакологическим эффектам и механизму действия, выявлять лекарственные взаимодействия, а также количественно оценивать терапевтические и побочные эффекты соединений5. При этом во время оценки ЭЭГ-эффектов препарата проводится сравнение между основной и медикаментозной активностью ЭЭГ. Также необходимо учитывать и то, что различные вещества могут вызывать один и тот же паттерн ЭЭГ, но несмотря на большую индивидуальную вариабельность, некоторые особенности ЭЭГ можно считать характерными, или даже специфичными для конкретных препаратов.
Основные положения:6
- лекарственные средства со сходным психотропным эффектом имеют близкие количественные ЭЭГ характеристики.
- препараты с одинаковыми фармако-ЭЭГ-профилями имеют сходные экспериментально-фармакологические показатели.
- по данным фармако-ЭЭГ можно выявить психотропный потенциал у препаратов, известных в экспериментальной фармакологии в качестве средств для лечения различных соматических заболеваний, но не в качестве психотропных средств.
- ЭЭГ-профиль выступает в роли адекватного, быстрого, экономичного и безвредного для пациента показателя биодоступности психотропных препаратов. Иными словами, если ЭЭГ-реакция на пробную дозу психоактивного средства оказывается нетипичной или слабовыраженной, то клиницисту не следует ожидать хорошего терапевтического эффекта от выбранного препарата.
История развития фармако-ЭЭГ
Фармако-ЭЭГ-исследования существуют уже более семи десятилетий78. История современной клинической фармако-ЭЭГ берет начало из исследований Ганса Бергера, который впервые отметил изменения в биоэлектрической активности мозга человека на фоне применения кокаина, морфина, скополамина и хлороформа, при этом каждое химическое вещество вызывало различные изменения частоты и амплитуды биопотенциалов910.
Расцвет психофармакологии в 1950-е гг. повлек за собой расширение фармако-ЭЭГ-исследований. В 1953 г. был изучен резерпин, в 1954 г. – хлорпромазин, в 1957 г. – имипрамин, при этом для каждого исследуемого соединения были описаны характерные паттерны ЭЭГ. К 1960 г. ЭЭГ-анализ психоактивных препаратов стал методом ранней клинической оценки действия лекарственных средств.
Термин «количественная фармакоэлектроэнцефалография» (КФЭЭГ) впервые обнаруживается в работе T.M. Itil в 1974 г.11 для обозначения процесса, который включает в себя использование компьютерного анализа спонтанной ЭЭГ и серию статистических процедур, направленных на выявление центрального действия новых лекарственных средств, предсказание их клинического (психотропного) действия, оценку эффективной дозы и продолжительности действия после приема разовой терапевтической дозы.
В 1980 г. на научной конференции в Берлине, посвященной фармакологическому анализу ЭЭГ, было основано Международное общество фармако-ЭЭГ (International Pharmaco-EEG society, IPEG). Впоследствии многочисленные международные исследования подтвердили гипотезу о существовании специфических ЭЭГ-профилей для определенных групп психофармакологических средств.1213
Возможности фармако-ЭЭГ
И в экспериментальных, и в клинических исследованиях новых веществ поиск специфических биомаркеров для выявления лекарственно-индуцированных эффектов может осуществляться с помощью ЭЭГ. Профили фармако-ЭЭГ лекарственных средств различных классов широко используются для идентификации и классификации активных психотропных веществ, выявления эпилептической активности для подтверждения эпилептической природы приступных расстройств, для контроля эффективности проводимого лечения, определения оптимальных доз препаратов.
Методика активно применяется в медицинской практике для определения глубины анестезии.
Несомненными достоинствами клинической ЭЭГ являются объективность, возможность непосредственной регистрации показателей функционального состояния мозга, количественной оценки получаемых результатов, наблюдения в динамике, что необходимо для оценки прогноза развития заболевания14.
Компьютеризация ЭЭГ-исследований, расширение программного обеспечения, развитие новых технологий превращает ЭЭГ в ценный комплексный показатель, необходимый для объективной оценки исходного функционального состояния мозга и динамики патологических проявлений на фоне протекающей терапии. Компьютеризованная или цифровая ЭЭГ открывает новые перспективы для предикции свойств препаратов и эффективности фармакотерапии, а также для углубленного анализа нейрофизиологических закономерностей в развитии и редукции психических нарушений. Метод компьютеризированной ЭЭГ с использованием математических методов анализа биоэлектрической активности нашел широкое применение в крупномасштабных клинических испытаниях и признан адекватным для определения профилей фармако-ЭЭГ для различных классов лекарственных средств в неврологии и психиатрии15.
Количественная ЭЭГ существует уже более 40 лет. С учетом последних достижений в технологии количественная ЭЭГ играет все более важную роль на всех этапах разработки лекарственных препаратов. Комбинируя сильные стороны различных методов, фармако-ЭЭГ обеспечивает более полную характеристику спектра фармакологических реакций ЦНС16.
Основные достижения
С момента публикации первых руководящих принципов фармако-ЭЭГ в 1982 г. технические условия и методы обработки данных значительно продвинулись, повышая качество данных и расширяя палитру инструментов, доступных для изучения действия лекарственных средств на ЦНС.
С помощью фармако-ЭЭГ были выявлены миансерин (GB-94) и доксепин – вещества с антидепрессивной активностью, близкой к имипрамину.
При тестировании антагонистов опиоидных рецепторов (налоксона и циклазоцина), а также веществ с опиоидной актиностью (метадон, левометадил) для лечения наркотической зависимости с помощью количественной фармакоэлектроэнцефалографии были установлены оптимальные схемы дозирования.
В лаборатории психофармакологии Научно-исследовательского института фармакологии Российской академии медицинских наук (РАМН) впервые проведено исследование влияния бензодиазепиновых транквилизаторов на биоэлектрическую активность различных структур головного мозга крыс в условиях свободного поведения, что позволило определить не только динамику изменений ЭЭГ у бодрствующих животных, но и выявить влияние препаратов на структуру циклов «сон-бодрствование»1718. Комплексные экспериментально-клинические исследования впервые были проведены в содружестве с психиатрами Г.Я. Авруцким и Ю.А. Александровским в Московском научно-исследовательском институте психиатрии19.
Определены клиникоэлектрофизиологические показатели паркинсонического синдрома20 и электрофизиологические механизмы реализации действия ноотропных21 и противосудорожных препаратов22.
На основе тесного многолетнего сотрудничества лаборатории психофармакологии ФГБНУ «НИИ фармакологии им. В.В. Закусова» и кафедры неврологии РГНУ имени Н.И. Пирогова разработаны алгоритмы обработки данных фармако-ЭЭГ-исследований с анализом когерентности, локализации эквивалентных дипольных источников биоэлектрической активности и математических показателей биоэлектрической активности для контроля эффективности различных классов лекарственных средств. На основании клинико-экспериментальных ЭЭГ-исследований была доказана патогенетическая обоснованность применения этилметилгидроксипиридина сукцината (Мексидола*) – антиоксиданта группы 3-оксипиридина в комбинированной патогенетической терапии больных парциальными эпилепсиями с целью оптимизации лечения приступов2324, проведено исследование особенностей действия известных антипаркинсонических средств на биоэлектрическую активность головного мозга в эксперименте на животных и у пациентов с акинетико-ригидной и дрожательно-ригидной формами болезни Паркинсона на основе спектрально-когерентного анализа ЭЭГ25262728. В этих работах выявлена высокая информативность показателя когерентности межзональных связей ЭЭГ, в особенностях которых находят отражение различные аспекты терапевтической динамики неврологических расстройств.
До настоящего времени ЭЭГ остается объективным методом диагностики эпилепсии, определения формы заболевания и дифференциальной диагностики с другими пароксизмальными состояниями. ЭЭГ отражает один из основных параметров работы нервной системы – свойство ритмичности, отражающее согласованность работы разных структур мозга. Изменения в ЭЭГ стали основой для классификации новых лекарственных средств2930, контроля побочных эффектов и токсичности лекарственных средств31.
С использованием метода количественной фармако-ЭЭГ установлено, что бензодиазепиновые транквилизаторы разных типов (диазепам, феназепам, гидазепам) оказывают общее специфическое действие на спектры мощности сенсомоторной коры и дорзального гиппокампа крыс, уменьшая мощность спектра в θ-диапазоне (5-7 Гц) и увеличивая мощность спектра ß-диапазона (12-32 Гц) с наиболее высоким пиком в диапазоне 12-16 Гц, что существенно отличает их от психотропных препаратов других классов: нейролептиков, психостимуляторов, ноотропов и др.3233343536.
Выполненные фундаментальные исследования легли в основу действующих в настоящее время Методических рекомендаций по преклиническому изучению снотворных37 и противосудорожных препаратов38, которые обосновывают использование методов количественной фармако-ЭЭГ для прогнозирования эффектов новых препаратов в клинике.
Методология и стандартизация метода электроэнцефалографии в фармакоэнцефалографических исследованиях
Несмотря на то что фармако-ЭЭГ используется в исследовательских лабораториях в течение нескольких десятилетий3940, операционные процедуры не были стандартизированы до такой степени, чтобы обеспечить надежное сравнение данных полученных в различных исследовательских лабораториях, а это затрудняет обмен данными. ЭЭГ-исследования не всегда проводились на должном уровне, так как отсутствовали четкие критерии регистрации, анализа и интерпретации данных, практически отсутствовали алгоритмизированные и стандартизированные протоколы исследований, которые бы включали пошаговую инструкцию обследования в зависимости от задачи исследования.
В настоящее время благодаря разработке новых компьютерных технологий регистрация и анализ ЭЭГ характеризуются высоким уровнем временных и пространственных разрешений, что позволяет значительно расширить возможности метода. Широкое внедрение ЭЭГ-обследований при отсутствии нормативных документов (стандартов), обеспечивающих основные технические требования и порядок проведения ЭЭГ-обследования, привели к тому, что в некоторых подразделениях стали сокращать время регистрации ЭЭГ, запись ЭЭГ проводится в автоматизированном режиме без функциональных нагрузок. В связи с этим остро встал вопрос о разработке новых стандартов проведения ЭЭГ-обследования. В 2012 г. группой экспертов ЭЭГ Международного фармакоэлектроэнцефалографического общества (IPEG) с целью повышения сопоставимости данных из различных лабораторий были разработаны рекомендации по стандартизации фармако-ЭЭГ-исследований человека. В рекомендациях IPEG тщательно представлены технические детали и условия проведения ЭЭГ-исследования.
Согласно методическим рекомендациям IPEG, при записи ЭЭГ необходимо использовать стандартные схемы расположения электродов и их количество. Важно использовать международную схему расположения электродов по системе 10-20, использовать режим записи ЭЭГ в покое и при использовании стандартных функциональных нагрузок. Интерпретация данных зависит от качества записи ЭЭГ, что требует строгого соблюдения требований по техническому оснащению, качеству программного обеспечения.
Серьезным нарушением международных стандартов является регистрация ЭЭГ в биполярном монтаже, что исключает ремонтаж записи при анализе, так как при этом исключается возможность выявить наличие генерализованной пароксизмальной активности. В качестве примера на рис. 1, А представлены электроэнцефалограммы пациента с вторично-генерализованными судорожными припадками (ВГСП), зарегистрированные в референциальном монтаже, где отчетливо выявляются генерализованные синхронные разряды групп θ-волн и полиспайки в передних отделах мозга, на рис 1, Б представлен тот же отрезок ЭЭГ, в биполярном монтаже, где пароксизмальная активность представлена слабо, однако выявляется локальный очаг δ-активности в правой височной области.
Исследования фармако-ЭЭГ должны быть разработаны в соответствии с задачами исследования (в том числе плацебо-контролем и/или эталонного препарата) при хорошо контролируемых стандартных условиях. Схема проведения функциональных нагрузок должна учитывать характер нарушений.
На следующих рисунках представлены ЭЭГ пациента в возрасте 57 лет с жалобами на провалы памяти. В анамнезе черепно-мозговая травма с потерей сознания. В фоновой записи ЭЭГ отмечаются синхронные билатеральные разряды групп θ и δ-волн, генерализованные по всем отделам, с акцентом в левой височной области (рис. 2, А).
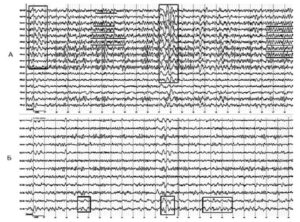
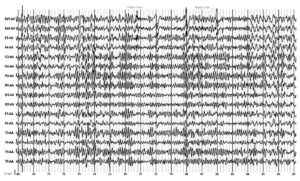

При проведении гипервентиляции появляются частые высокоамплитудные генерализованные эпилептиформные разряды. На основании данных ЭЭГ-обследования был установлен диагноз «парциальная эпилепсия» и скорректирована терапия (рис. 2, Б).
Наличие у больных эпилепсией идеаторных, когнитивных, эмоционально-аффективных, иллюзорных, галлюцинаторных, амнестических припадков делает необходимым проведение дифференциального диагноза для подбора адекватной терапии. Вопросам дифференциальной диагностики различных форм эпилепсии и заболеваний другой этиологии уделялось большое внимание на Международном форуме стран Содружества Независимых Государств «Эпилепсия и пароксизмальные состояния», проходившем в Ереване в октябре 2011 г., в выступлениях эксперта Европейской комиссии Международной противоэпилептической лиги профессора Л.Р. Зенкова (Москва), профессора Н.Н. Заваденко (Москва), профессора С. Гроппа (Кишинев). В 2016 г. на Международном форуме стран Содружества Независимых Государств «Эпилепсия и пароксизмальные состояния», проходившем в Сочи, были приняты Рекомендации экспертного совета по нейрофизиологии Российской противоэпилептической лиги по проведению рутинной ЭЭГ. Стандартные операционные процедуры предусматривают минимальные стандарты проведения записи, усиления и фильтрации, проверки аппаратных средств и программного обеспечения, количественной обработки данных. В основе большинства современных компьютерных программ лежит спектральный анализ ЭЭГ на базе дискретного преобразования Фурье с графическим представлением и картированием результатов обработки (спектров мощности и амплитуды, КОГ и пр.) для всех физиологически значимых диапазонов частот. Метод компьютеризированной ЭЭГ с анализом математических показателей спектрально-когерентного и корреляционого анализа, локализации эквивалентных дипольных источников пароксизмальной активности головного мозга адекватен для диагностики и определения эффективности лечения при проведении динамического наблюдения.
В настоящее время Международным фармакоэлектроэнцефалографическим обществом были разработаны и опубликованы следующие рекомендации:
- Рекомендации по записи и оценке данных фармако-ЭЭГ у человека41;
- Рекомендации по записи и оценке исследований фармако-ЭЭГ сна у человека42;
- Стандартная операционная процедура (СОП) для регистрации и компьютерной поддержке для оценки данных фармако-ЭЭГ43.
Фармакоэлектроэнцефалографические исследования
Оценка и количественное определение эффектов в фармако-ЭЭГ обеспечивается широким набором методов, позволяющих выявить терапевтические преимущества и возможные неблагоприятные последствия, которые препарат может вызывать у пациентов. Комбинируя различные методы ЭЭГ, можно обеспечить более полную характеристику спектра реакций ЦНС на фармакологическое воздействие. В последние годы техническое оборудование и методы обработки данных ЭЭГ-исследований значительно усовершенствовались, повышая тем самым качество получаемых данных и расширяя палитру инструментов, доступных для изучения действия лекарственных средств.
Основной целью применения ЭЭГ в клинических исследованиях новых веществ является поиск специфических биомаркеров. Количественная ЭЭГ и современные методы исследования с учетом последних достижений в технологии ЭЭГ имеют высокий потенциал, для того чтобы выявить надежные биомаркеры эффектов лекарственных препаратов и играют все более важную роль на всех этапах разработки лекарственных препаратов.
Профили фармако-ЭЭГ различных классов лекарственных средств широко используются прежде всего для:
- оценки действия известных нейротропных препаратов;
- идентификации эффектов новых лекарственных средств;
- контроля эффективности проводимого лечения. Использование ЭЭГ в качестве биомаркера при разработке новых лекарственных средств требует тщательной интерпретации.
Фармакоэлектроэнцефалографические исследования при анализе эффектов противоэпилептических препаратов в клинической практике
Эпилепсия – хроническое заболевание нервной системы, одно из наиболее распространенных патологических состояний в мире. Современный этап изучения эпилепсий и эпилептических синдромов ознаменовался внедрением новых диагностических методик: цифровой ЭЭГ с возможностью компьютерной обработки данных, фармако-ЭЭГ-исследования, новейших методов нейровизуализации. Однако до сих пор мало изучены нейрофизиологические механизмы формирования эпилептической системы, не достаточно разработаны патогенетические подходы к медикаментозной коррекции эпилепсий, основанных на новых методах исследования.
В качестве примера использования фармако-ЭЭГ-подхода для анализа действия противоэпилептических средств приводим выполненные нами исследования по изучению эффектов топирамата (Топамакса), вальпроевой кислоты (Депакина Хроносферы), этилметилгидроксипиридина сукцината (Мексидола) и комбинации вальпроевой кислоты (Депакина Хроносферы) и этилметилгидроксипиридина сукцината (Мексидола) у больных эпилепсией.
Во всех сериях исследований компьютерный анализ ЭЭГ осуществлялся с помощью программы Brainsys. Программный комплекс выполнял следующие функции: ввод в компьютер многоканальной ЭЭГ и ее визуальное редактирование; фильтрацию, выделение артефактов и их устранение из анализируемого отрезка ЭЭГ; спектральный и корреляционный анализ ЭЭГ и статистическую обработку полученных результатов.
Статистический анализ влияния исследуемого препарата на биоэлектрическую активность головного мозга пациентов проводили, вычисляя изменения мощности спектров в диапазоне δ-, θ-, α- и ß-частот. Для этого использовали метод вычитания, при котором из суммарной мощности спектра ЭЭГ, зарегистрированной после приема препарата, с ЭЭГ вычитали суммарную мощность спектра фоновой ЭЭГ с выведением результатов в абсолютных единицах мощности спектра.
При статистической обработке ЭЭГ с использованием компьютерной программы вычисления величин Стьюдента со знаком проводили при сравнении суммарной мощности спектра ЭЭГ, зарегистрированной после приема препарата (N1) и суммарной мощность спектра фоновой ЭЭГ (N2) с выведением t-критерия Стьюденда со знаком. Сравнительный статистический анализ когерентности различных групп с использованием параметрических критериев (критерий Стьюдента) проводили с использованием нормализованных коэффициентов когерентности, позволяющих привести эту случайную величину к распределению Гаусса, вычисляемых по формуле Дж. Бендат, А. Пирсол44.
Подробнее:
Фармакоэлектроэнцефалографические исследования при анализе эффектов антипаркинсонических препаратов в клинической практике
В последние десятилетия во многих странах мира с увеличением средней продолжительности жизни населения отмечается значительное увеличение распространенности болезни Паркинсона (БП), что сопряжено с высокими социально-экономическими потерями45. Изучение функциональной активности головного мозга методом ЭЭГ – широко применяемый и необходимый диагностический прием в неврологии, особенно при эпилепсии, инсультах, черепно-мозговых травмах. Что касается БП, чаще всего для диагностики этого заболевания и эффективности проводимого в клинике лечения используется оценка моторных нарушений и динамики их регресса.
Вместе с тем для анализа функциональной активности мозга, взаимоотношений между его различными структурами, участвующими в формировании патологических систем, высокую степень информативности имеет изучение пространственной организации биопотенциалов мозга методом спектрально-когерентного анализа ЭЭГ, который, однако, в клинике паркинсонизма пока широко не применяется.
Применение ЭЭГ-методов в клинике БП повышает уровень диагностики и мониторирования эффективности лечения больных, позволяет расширить представление об особенностях перестроек пространственной организации ЭЭГ в различных структурах мозга при формировании нейропатологической основы паркинсонического синдрома и оценить эффективность действия антипаркинсонических препаратов.
Подробнее:
Footnotes
- Бочкарев В.К. Оценка эффективности действия ноотропов у больных астеническими расстройствами с использованием метода электроэнцефалографии // Фарматека. – 2009. – № 7. – С. 73-78
- Бочкарев В.К., Файзуллоев А.З. Электроэнцефалографические корреляты астенических расстройств и нарушений когнитивных функций в процессе терапии ноотропными препаратами: результаты когерентного анализа // Фарматека. – 2011. – № 20. – С. 233.
- Незнамов Г.Г., Бочкарев В.К., Реутова М.А., Сюняков С.А. Межзональные связи на ЭЭГ и их соотношение с субъективной оценкой действия однократной дозы феназепама у больных с тревожными расстройствами // Журн. неврологии и психиатрии им. С.С.Корсакова. – 2012. – № 3. – С. 50-56.
- Середенин С.Б, Незнамов Г.Г., Бочкарев В.К., Сюняков С.А., Чумаков Д.В. Результаты клинического изучения селективного анксиолитика афобазола // Экспериментальная и клиническая фармакология. – 2001. – № 2. – С. 15-19.
- https://www.karger.com/Article/FullText/343478
- Бочкарев В.К., Панюшкина С.В. Количественная фармако-электроэнцефалография: возможности и достижения (обзор литературы) // Рос. психиатр. журнал. – 1998. – № 6. -С. 57-61.
- Brazier M.A.B. The effect of drugs on the electroencephalogram of man // Clin. Pharmacol. Ther. – 1964. – Vol. 5. – P. 102-116.
- Fink M. Pharmaco-electroencephalography: a note on its history // Neuropsychobiology. -1984. – Vol. 12. – P. 173-178.
- Berger H. Über das Elektrenkephalogramm des Menschen. [On the electroencephalogram of humans] // Archiv. für Psychiatrie und Nervenkrankheiten. – 1929. – Vol. 87. – P. 527-570.
- Berger H. On the electroencephalogram of man: The fourteen original reports on the human electroencephalogram // Electroencephalography Clin. Neurophysiology. – 1969. – Vol. 28. – P. 1-350.
- Itil T.M. Quantitative pharmaco-electroencephalography // Psychotropic Drugs and the Human EEG. Modern Problems in Pharmacopsychiatry / Ed. by Itil T.M. Basel, New York: Karger. -1974. – V. 8. – P. 43-75.
- Панюшкина С.В. Некоторые нейрофизиологические аспекты психофармакологии (обзор зарубежной литературы) // Фармакология и токсикология – 1980. – № 6. – С. 736-740.
- Thomas Budzynski, Rex L. Cannon, James R. Evans. Introduction to Quantitative EEG and Neurofeedback. – Elsevier Inc., 2009. -492 p.
- Авакян Г.Н., Гроппа С.А. Нейрофизиологические методы исследования в неврологии: монография. – Кишинев, 2008. – 376 с.
- Barbanoj M.J., Antonijoan R.M., Riba J., Valle M., Romero S., Jane F. Quantifying drug-drug interactions in pharmaco-EEG // Clin. EEG Neurosci. – 2006. – Vol. 37. – P. 108-120.
- Galderisi S., Sannita G. Pharmaco-EEG: a history of progress and a missed opportunity // Clin. EEG Neurosci. – 2006. – Vol. 37. – P. 61-65.
- Воронина Т.А., Кадлецова О.Л., Вихляев Ю.И. Влияние нитразепама при его длительном применении на циклы сна у крыс // Бюлл. Экспер. Биол. и Мед. – 1976. – № 2. – С. 188-190.
- Воронина Т.А., Неробкова Л.Н. Влияние феназепама на циклы сна у крыс // Фармакокология и Токсикология – 1982. – № 1. – С. 18-20.
- Александровский Ю.А. Клиническая фармакология транквилизаторов. – М.: Медицина, 1973.
- Крыжановский Г.Н., Воронина Т.А., Атаджанов М.А., Неробкова Л.Н. Клинико-электрофизиологические показатели паркинсонического синдрома, вызванного МФП+ у крыс // Бюлл. Экспер. Биол и Мед. – 1989. – № 2. – С. 147-150.
- Воронина Т.А., Крапивин С.В., Богданов Н.Н. Нейрофизиологический анализ действия ноотропных препаратов // Вестн. АМН СССР. – 1987- № 2. – С. 17-27.
- Воронина Т.А., Неробкова Л.Н., Алиев А.Н., Крыжановский Г.Н. К вопросу о электрофизиологических и биохимических механизмах противосудорожного действия антиоксидантов из класса 3-оксипиридина// Бюлл. Экспер. Биол и Мед. – 1986. – № 12. – С. 663-665.
- Авакян Т.Н., Стойко М.И., Бадалян О.Л., Бурд С.Г. Применение антиоксиданта группы 3-оксипиридина в комбинированной патогенетической терапии больных парциальными эпилепсиями // Неврол. и психиат. – 2005. – Т. 105, № 6. – С. 21-25.
- Гусев Е.И., Авакян Г.Н. Современная эпилептология // Эпилепсия и пароксизмальные состояния. – 2011. – Т. 3, № 4. – С. 24-27.
- Воронина Т.А., Неробкова Л.Н., Катунина Е.А. и др. Особенности функциональной активности головного мозга у больных болезнью Паркинсона на фоне лечения амантадин-сульфатом // Журн. неврол и психиат. – 2005. – Т. 105, № 4. – С. 17-21.
- Неробкова Л.Н., Филатова Ю.Б., Воронина Т.А., Авакян Г.Г., Хромых Е.А., Гайдуков И.О., Авакян Г.Н. Изучение электрофизиологических механизмов регресса патологической системы у больных эпилепсией с использованием спектрально-когерентного анализа и метода дипольных источников // Эпилепсия и пароксизмальные состояния. – 2013. – Т. 5, № 1. – С. 22-30.
- Авакян Т.Н., Воронина Т.А.., Вальдман Е.А. и др. Клинико-нейрофизиологическое и экспериментальное изучение особенностей применения сульфата адамантана при болезни Паркинсона // Журн Неврол. и психиат. – 2004. – Т. 104, № 9. – С. 18-22.
- Nerobkova L.N., Voronina T.A, Katunina E.A., Malykhina E.A., Kapitsa I.G., Arakelyan R.K., Avakyan G.N. Perspectives of the use of a new antioxidant mexidol in the treatment of Parkinson’s disease. Abstr. of the 8 th ECNP Regional Meeting. 2005, Moscow, Russia // European Neuropharmacology. – 2005. – Vol. 15, Suppl. 2. – P. 203-204.
- Saletu B., Anderer P., Kinsperger K., Grünberger J. Topographic brain mapping of EEG in neuropsychopharmacology. Part II. Clinical applications (pharmaco EEG imaging //Methods Find Exp. Clin. Pharmacol. – 1987. – Jun. – Vol. 9, N 6. – P. 385-408.
- Saletu B., Anderer P., Saletu-Zyhlarz G.M. et al. Classification and evaluation of the pharmacodynamics of psychotropic drugs by single-lead pharmaco-EEG, EEG mapping and tomography (LORETA) // Methods Find. Exp. Clin. Pharmacol. – 2002. – Vol. 24 (Suppl.) – P. 97-120.
- Barbanoj M.J., Antonijoan R.M., Riba J., Valle M., Romero S., Jane F. Quantifying drug-drug interactions in pharmaco-EEG // Clin. EEG Neurosci. – 2006. – Vol. 37. – P. 108-120.
- Богданов Н.Н., Воронина Т.А. Взаимосвязь анксиолитического эффекта диазепама и изменений спектров мощности ЭЭГ крысы // Бюлл. Экспер. Биол. и Мед. – 1989. – № 8. – С. 199-202.
- Воронина Т.А., Неробкова Л.Н. Роль гиппокампального θ-ритма в проявлении анксиолитического действия феназепама // Бюлл. Экспер. Биол. и Мед. – 1983. – № 5. – С. 62-64.
- Вихляев Ю.И., Воронина Т.А. Фармакология феназепама. Экспресс-информация: новые лекарственные препараты. – М.: ВНИИМИ, 1978. – Т. 3. – С. 265-279.
- Воронина Т.А. Положение Феназепама среди препаратов бензодиазепинового ряда. Новые психотропные средства // мат-лы симп. – Львов, 1978. – 100 с.
- Андронати С.А., Авруцкий Г.Я., Богатский А.В. и др. Феназепам. – Киев, 1982. – 288 с.
- Воронина Т.А., Неробкова Л.Н. Методические рекомендации по изучению снотворной активности фармакологических веществ. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. – М.: ИИА Ремедиум, 2000. – С. 131-137.
- Воронина Т.А., Неробкова Л.Н. Методические рекомендации по доклиническому изучению противосудорожной активности лекарственных средств. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. – М.: Гриф и К, 2012. – Гл. 14. – С. 235-250.
- Brazier M.A.B. The effect of drugs on the electroencephalogram of man // Clin. Pharmacol. Ther. – 1964. – Vol. 5. – P. 102-116.
- Fink M. Pharmaco-electroencephalography: a note on its history // Neuropsychobiology. -1984. – Vol. 12. – P. 173-178.
- Guidelines for the recording and evaluation of pharmaco-EEG data in man the International Pharmaco-EEG Society (IPEG) // Neuropsychobiology. – 2012. – Vol. 66. – N 4. – P. 201-220
- Guidelines for the recording and evaluation of pharmaco-sleep studies in man: the International Pharmaco-EEG Society (IPEG) // Neuropsychobiology. – 2013. – Vol. 67. – N 3. -P. 127-167
- Versavel M., Leonard J.P., Herrmann W.M. On the choice of recording duration in pharmaco-EEG studies // Neuropsychobiology. – 2015. -Vol. 72. – N 3-4. – P. 165-177
- Бендат Дж., Пирсол А. Измерение и анализ случайных процессов: пер. с англ. – 1974. – 464 с.
- Кривонос О.В., Федорова Н.В., Чигирь И.П. Лечение поздних стадий болезни Паркинсона толкапоном // Журнал неврологии и психиатрии им. С.С. Корсакова. – 2004. – Т. 104, № 10. – С. 26-30.