Альфа-α-Активность представляет собой синусоидальные колебания частотой 8-13 Гц и амплитудой 40-100 мкВ, выявляется при проведении ЭЭГ в состоянии пассивного бодрствования.
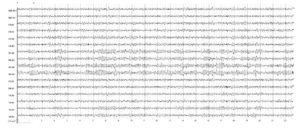
α-Ритм – регулярная волновая активность с частотой 8-12 Гц. Он характеризуется спонтанными изменениями амплитуды (модуляции), выражающимися в чередующемся нарастании и снижении амплитуды волн с образованием так называемых веретен длительностью от 2 до 8 с. В норме α-ритм доминирует в затылочных отделах мозга, убывает по амплитуде от затылка ко лбу, симметричен по частоте и амплитуде, к тому же наблюдается функциональная асимметрия с незначительным превышением амплитуды в доминирующем полушарии вследствие функциональной асимметрии мозга. Количественной характеристикой альфа-ритма является индекс альфа-активности. Индекс α-активности в затылочно-теменных отделах коры составляет 75-95% (рис. 1).
Важно отметить, что в показателях биоэлектрической активности мозга существуют некоторые индивидуальные различия. Известно, что на ЭЭГ некоторых здоровых лиц α-ритм отсутствует (10-30% общей выборки), а в некоторых случаях α-активность усилена по сравнению с наиболее часто встречающимися вариантами нормы. Появление высокоамплитудного α-ритма в височных областях может свидетельствовать об эпилептиформных изменениях. Высокая амплитуда более характерна для замедленного α-ритма. При асимметрии α-активности по амплитуде более чем на 35-50% следует предположить наличие патологического процесса. Признаки дезорганизации α-ритма значимы, если периоды соседних волн отличаются на 1-2 Гц и более, при этом форма α-волн искажена, а модуляции амплитуд нечеткие или беспорядочные.
Депрессия α-ритма и замедление его частоты также наблюдаются при заболеваниях, сопровождающихся гипертермией.
Более подробно: Нарушения альфа-ритма: депрессия, асимметрия, дезорганизация, нерегулярность
Нейронные механизмы
Взаимосвязь с корковой дезактивацией
Электрическая стимуляция внутриламинарных ядер таламуса подавляет альфа-ритмы (реакция десинхронизации). Высокочастотная стимуляция таламических ядер может увеличивать суммарную активность коры, действуя как при реакции пробуждения (arousal). В соответствии с этими наблюдениями, повреждения в таламусе ведут к отчетливой дезорганизации или даже полному подавлению альфа-активности в ЭЭГ. Эти данные подтверждают ранние предположения, что альфа-ритмы контролируются регулярной таламической активностью.
Исследования корреляции между позитронно-эмиссионный-томографическими, ЭЭГ- или фМРТ-сигналами поддерживают гипотезу о том, что альфа-активность представляет собой ритмы состояния «холостого хода» соответствующих корковых областей. Для затылочного альфа-ритма это показано во многих независимых статьях. Поведенческая парадигма, используемая в этих исследованиях, состоит из последовательного открывания и закрывания глаз, которые, соответственно, ведут к подавлению и повышению затылочной альфа-активности. В большинстве современных исследований показано, что во время увеличения затылочных альфа-ритмов наблюдается уменьшение активации затылочных областей, измеряемой методами оценки насыщенности крови кислородом, кровотока или метаболизма глюкозы. Связи метаболических параметров подкорковых (включая таламические) структур с амплитудой альфа-активности ЭЭГ менее хорошо изучены и противоречивы.
Таламокортикальные пути
Одна из первых идей в 1960-х заключалась в том, что альфа-ритмы и сонные веретена естественного сна имеют подобные нейронные механизмы. В те годы Andersen и коллеги выполнили ряд изящных экспериментов, показывающих, что веретена барбитуратного сна генерируются на уровне таламуса. Ключевую роль в генерации веретен барбитуратного сна играли фазически разряжающиеся тормозные нейроны, приводящие к вспышкам потенциалов действия в таламических нейронах (поcтингибиторный обратный эффект), имеющих проекции к коре. Сначала считалось, что эти тормозные нейроны являются интернейронами локальных цепей, но позже было показано, что в действительности эти клетки — тормозные ГАМКергические нейроны, расположенные в ретикулярном ядре таламуса.
Необходимо более подробно описать схему и принципы информационного потока в таламусе. Таламус — парные ядра, расположенные около центра мозга, — играет определяющую роль в управлении информационными потоками от рецепторов к сенсорным областям коры. За эту функцию он и получил свое название «ворота к коре». Действительно, почти каждый бит сенсорной информации попадает в кору через таламус. Помимо этой функции, связанной с сенсорными входами, таламус также играет важную роль в модуляции потока информации в ассоциативные, моторные и эмоциональные корковые области.
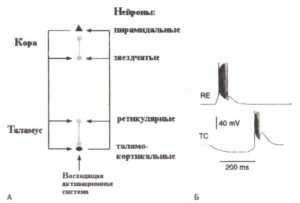
Существуют две главные компоненты таламуса: дорзальный таламус (мы будем называть его таламус), состоящий примерно из 15 ядер, и вентральный таламус, главной частью которого является ретикулярное ядро. Ретикулярное ядро формирует своего рода щит вокруг дорзального таламуса (рис. 8). Оно состоит из тормозных ГАМКергических нейронов, которые имеют обратные проекции к таламусу Ретикулярные нейроны получают прямые возбуждающие проекции от таламуса, возбуждающие проекции обратной связи от коры и тормозные проекции восходящих активирующих систем ствола мозга (рис. 9).
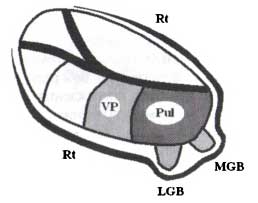
Связанные с сенсорными потоками ядра таламуса могут быть разделены на релейные ядра первого порядка и ядра высшего порядка. Релейные ядра первого порядка получают сенсорную информацию непосредственно от рецепторов, в то время как переключающие ядра высшего порядка получают сенсорную информацию, обработанную на более высоких иерархических слоях: 1) от корковых сенсорных областей посредством кортико-таламических проекций; 2) от ядер, вовлеченных в моторные действия (такие как ориентация тела, головы или глаз). Примеры ядер первого порядка — латеральное коленчатое тело для зрительной модальности, медиальное коленчатое ядро для слуховой модальности и заднее вентральное ядро для соматосенсорной модальности (рис. 8). Примеры ядер высшего порядка — подушка таламуса для зрительной модальности, заднее ядро для соматосенсорной модальности (рис.8).
Простейший взгляд на таламус подчеркивает его релейную функцию, то есть способность передавать сенсорную информацию к коре. Однако анатомические данные указывают, что даже для таламических ядер первого порядка первичные сенсорные входы составляют меньше чем 20 % всех синаптических входов. Этот факт поддерживает другой (и более реалистичный) взгляд на таламус, подчеркивающий значение несенсорных входов таламуса и, следовательно, его модулирующую функцию. Сложные цепи, включающие таламические, ретикулярные и корковые узлы, играют важную роль в модуляции сенсорного информационного потока к коре. Способ сенсорной модуляции, по-видимому, существенно зависит от состояния мозга и отличается в разных стадиях сна и в различных стадиях информационного потока во время бодрствования.
Сонные веретена
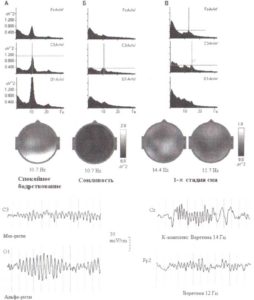
Описание модуляторных функций таламуса мы начнем с описания сонных веретен. Веретена сна появляются в ЭЭГ только во время легкой дремоты (стадия 2) или медленноволнового сна (стадии 3 и 4). Это ритмичные синусоидальные волны с частотами от 10 до 14 Гц. Волны сгруппированы в циклы (вспышки) продолжительностью 0,5—3 секунды, которые могут повторяться с интервалами 3-10 секунд. Веретена сна проявляются в очень раннем возрасте (6—8 недель), наиболее выражены во время детства и юности и снижаются по амплитуде с возящим. Примеры веретен сна одного здорового человека в возрасте 23 лет представлены на рис. 10.
Упрощенная схема генерации веретен сна представлена на рис. 9. Согласно пой схеме, для генерации веретен необходима сеть, состоящая по меньшей мере и»двух цементов — таламического ретикулярного нейрона и таламокортикального нейрона, и взаимодействие между ними. Согласно этой схеме, вспышка импульсов тормозных нейронов ретикулярного таламического ядра вызывает сильные тормозные постсинаптические потенциалы в таламокортикальных нейронах. Эта гиперполяризация деинактивирует низкопороговый поток Са++. Поток Са++ вовнутрь вызывает обратную деполяризацию (обратный эффект) таламокортикальных клеток (Са++-спайк) и возникновение вспышки. Разряды таламокортикальных клеток возбуждают ретикулярные нейроны посредством прямых связей, позволяя циклу начаться снова.
Спонтанные веретена синхронизованы на больших корковых областях. Кортико-таламические пути играют важную роль в этой синхронизации. Действительно, перерезка этих путей вызывает десинхронизацию таламической активности, которая изменяется в дезорганизованный паттерн с низкой пространственно-временной когерентностью.
Альфа-ритмы в состоянии бодрствования
Необходимо подчеркнуть, что нейронная схема, описанная выше, базируется на исследованиях, проведенных на анестезированных животных, и объясняет механизм генерации особого типа альфаподобных колебаний — сонных веретен. Веретена сна состоят из растущих и уменьшающихся колебаний потенциалов в диапазоне частот 10—14 Гц. В отличие от альфа-вспышек (которые могут длиться долго) веретена сна обычно короче и длятся только 1—3 секунды, снова возникая каждые 5—15 секунд. Хотя некоторые авторы попытались перенести механизмы генерации веретен сна для объяснения альфа-ритмичности в состоянии бодрствования, недавние исследования привнесли сомнения в это простое объяснение. Действительно, более детальное рассмотрение показывает, что веретена сна и альфа-ритмы — различные явления.
Во-первых, альфа-ритмы и веретена сна проявляются в двух очень разных поведенческих состояниях (в состоянии расслабленного бодрствования по сравнению с состоянием сна или анастезии). Во вторых, α-ритмы случайно увеличиваются и уменьшаются в течение нескольких секунд, тогда как барбитуратные веретена имеют более короткую продолжительность. В-третьих, альфа-ритмы у людей имеют локальное корковое распределение, ограниченное первичными сенсорными областями, тогда как веретена сна более широко распространены с максимумом в центральных областях. И наконец, альфа-ритмы имеют более низкую частоту, чем сонные веретена.
Новая стадия в поисках нейронных механизмов генерации альфа-ритмов наступила совсем недавно с открытием того, что колебания в диапазоне альфа-частот можно смоделировать in vitro на препарате среза латерального коленчатого тела кошачьего мозга — части таламуса, передающей информацию зрительной коре (Hughes et al., 2004). Напомним, что в этом препарате таламуса корковая часть отсутствует и, следовательно, нет прямого способа смоделировать таламокорковые взаимодействия. Отсутствующие модулирующие обратные кортико-таламические взаимодействия можно смоделировать искусственно в экспериментальных условиях, фармакологически активизируя глутаматные рецепторы в местах контактов кортикально-таламических волокон и таламических нейронов.
Панковой режим высокопороговой пульсации таламических нейронов
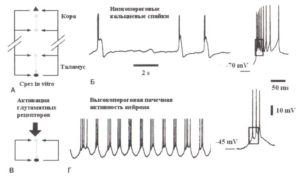
Внутриклеточная регистрация активности таламокорковых нейронов и препаратах срезов таламуса показывает новую форму вспышек (нейронных пачек), которые происходят при относительной деполяризации (> —55 мВ) мембранных потенциалов и названы высокопороговыми вспышками (Hughes et al., 2002; Hughes et al., 2004) (рис. 11). Наиболее существенное свойство высокопороговых вспышек заключается в том, что они происходят периодично в широком диапазоне частот, который охватывает альфа- и тета-ритмы (то есть 4—13 Гц), со специфической частотой в любой момент определяемой степени нейронной деполяризации. Было обнаружено, что более сильная активация глутаматных рецепторов ведет к появлению ритмов с альфа-частотами, тогда как уменьшение уровня активации вызывает тета-волны. Таким образом, на таламическом уровне, альфа- и тета-волны формируют непрерывную активность, которая генерируется одними и теми же нейронными механизмами. Можно допустить, что уменьшение in vitro уровня таламической глютаматергической активации соответствует снижению возбуждения (arousal) in vivo. Следовательно, наблюдаемое у отдельного человека замедление альфа-колебаний (например, ниже 7,5 Гц для затылочного альфа-ритма в состоянии бодрствования) может быть связано с уменьшением уровня активации (arousal) у этого человека.
Возникает вопрос: что заставляет таламокортикальные клетки генерировать колебания синхронно? Эксперименты in vitro продемонстрировали, что синхронизация высокопороговых разрядов, вызывающих ритмичные альфа- и тета-колебания, зависят от наличия щелевидных контактов между таламическими нейронами. Hughes et al. (2004) показали, что альфа- и тета-ритмы в препаратах срезов были восприимчивы к большому диапазону веществ, которые действуют на функции щелевидных контактов, но сохраняются после блокады обычной химической синаптической передачи.
Ритмичные вспышки таламокорковых нейронов в альфа-диапазоне передаются на корковые нейроны через таламокорковые пути. Входящие вспышки создают постсинаптические потенциалы, которые измеряются со скальпа в форме α-ритмов. Пространственное распределение корковых генераторов различных типов альфа-ритмов (полученные методом LORETA) показывает три различных таламических источника альфа-ритмов, соответствующих трем типам альфа-ритмов.
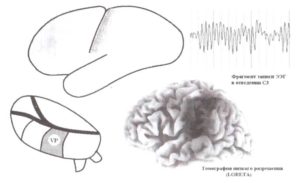
Первый таламический генератор расположен в заднем вентральном ядре и соотносится с сенсомоторным ритмом (рис. 12). Этот ритм генерируется в постцентральной борозде теменной доли, которая соответствует первичной соматосенсорной коре. Как мы знаем из анатомии и физиологии, эта часть человеческой коры получает проекции от заднего вентрального ядра таламуса — таламического ядра первого порядка соматосенсорной модальности.
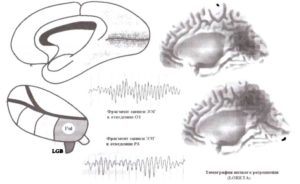
Два других таламических генератора соотносятся с затылочным и теменным альфа-ритмами (рис. 13). Затылочный альфа-ритм генерируется около шпорной борозды, которая относится к первичной зрительной коре. Эта область затылочной коры получает проекции от латерального коленчатого тела — релейного ядра первого порядка (зрительная модальность). Теменной α-ритм генерируется в 7-м поле Бродмана (ПБ 7). Эта область получает проекции от пульвинарного ядра таламуса (подушки) — релейного ядра второго порядка (зрительная модальность).
Как видно на рис. 12 и 13, только расположенные в задней части таламуса ядра (заднее вентральное, подушка, латеральное коленчатое ядро) вовлечены в генерацию альфа-колебаний в здоровом человеческом мозгу. Мы нс знаем, отражает ли этот факт относительно более низкий уровень деполяризации таламокорковых нейронов в этих ядрах или некоторые другие присущие клеткам этих ядер свойства или особенности нейронных сетей задних ядер таламуса.