Изменения спонтанной медленной электрической активности головного мозга животных и человека, по-видимому, прежде всего связаны с изменениями в характере функционирования центральной нервной системы. Исследования механизмов этих изменений — механизмов перестроек спонтанной активности — имеют большое теоретическое и практическое значение. Здесь мы кратко рассмотрим изменения электроэнцефалограммы в цикле сон — бодрствование, так называемую реакцию пробуждения (arousal-реакцию) и возможные нейрофизиологические механизмы этих явлений.
Электрическая активность мозга при бодрствовании. Эраузал-реакция
Если животному, находящемуся в состоянии дремоты, предъявить какой-либо раздражитель (особенно новый), то наряду с поведенческими проявлениями пробуждения (открывание глаз, настораживание и т. п.) в ЭЭГ медленные высокоамплитудные волны сменяются обычно десинхронизированной низковольтной высокочастотной активностью. Такое изменение ЭЭГ, как мы уже говорили, получило название реакции пробуждения (реакция активации, arousal-реакция). Применительно к человеку реакция пробуждения обычно выражается в блокаде (угнетении) α-ритма и поэтому называется реакцией блокады α-ритма, реакцией депрессии ЭЭГ, или реакцией десинхронизации.
Реакция пробуждения в ЭЭГ является одним из компонентов ориентировочной реакции и поэтому может угашаться при повторных предъявлениях раздражителя.
Реакцию пробуждения можно вызвать разными по модальности раздражителями. Причина этого стала понятна после того, как в 1949 г. Мэгун и Моруцци (Magoun, Moruzzi, 1949), раздражая ретикулярную формацию (РФ) среднего мозга у спящей кошки, получили как электрографическую, так и поведенческую картину пробуждения. При этом порог электрографической реакции оказался ниже, чем у поведенческого пробуждения.
➥ Более подробно: Общая классификация различных видов электрической активности головного мозга и их краткая характеристика
Впоследствии активирующая роль РФ подробно изучалась в лаборатории Моруцци и многими другими исследователями. Оказалось, что она получает коллатерали от всех афферентных путей, а также от большинства мозговых структур. В результате десинхронизация ЭКоГ может быть вызвана раздражителем любой модальности, а также высокочастотным электрическим раздражением большинства отделов мозга. В последнем случае реакция пробуждения опосредуется через РФ среднего мозга, что было убедительно доказано путем разрушения или отделения ее от раздражаемой структуры или от коры (Мэгун,1965).
Следует отметить, что РФ ствола мозга неоднородна по своему влиянию на корковую активность. Если ростральные ее отделы в среднем мозгу активируют кору, вызывая десинхронизацию, то каудальные отделы оказывают тормозное, синхронизирующее действие на ЭКоГ. Поэтому в настоящее время принято говорить об активирующей и тормозящей ретикулярных системах.
Электрографическое проявление реакции пробуждения не обязательно выражается в десинхронизации ЭКоГ. Пробуждающий раздражитель в зависимости от его силы может переводить мозг в более или менее активное состояние, но не обязательно в состояние бодрствования. Так, если человеку предъявить не очень сильный пробуждающий стимул во время дремоты или легкого сна, то электрографическим ответом может быть вспышка α-ритма, т. е. синхронизация ЭКоГ. В аналогичной ситуации у кошек может развиться а-подобная ритмика (Кратин, 1967).
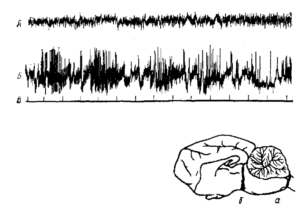
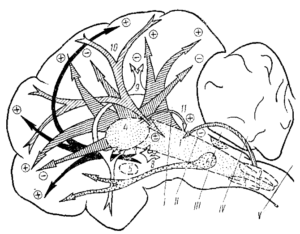
Длительное время активирующая РФ считалась основным, если не единственным, регулятором уровня бодрствования. Это представление прямо подтверждалось опытами с разрушением, отделением или блокадой РФ (Бремер, Моруцци и многие другие). Классическими стали в нейрофизиологии препараты мозга животного (Bremer, 1937) с перерезками ствола на бульбо-спинальном уровне (encephale isole) и на уровне среднего мозга (cerveau isole). Если при первой перерезке в ЭЭГ наблюдалась картина, характерная для бодрствования, то после второй — активность, типичная для сна (рис. 1). Однако позже были получены данные о том, что при длительном постепенном разрушении ретикулярных структур среднего мозга путем поточечной электрокоагуляции или введением некоторых веществ поведение животных и картина ЭКоГ сохраняют более или менее нормальный характер. Следовательно, есть и другие системы, которые помимо ретикулярной формации осуществляют контроль уровня бодрствования. В первую очередь, это активирующие системы заднего гипоталамуса (Tokizane, 1965) (рис. 2). Путем электрического раздражения этих структур было показано, что в отношении поведенческого пробуждения они имеют даже более низкий порог, чем РФ. В то же время они могут вызывать десинхронизацию ЭКоГ даже при полном разрушении мезенцефалической РФ, хотя в норме, несомненно, функционируют совместно (Баклаваджян, 1967). Наоборот, передние отделы гипоталамуса и особенно преоптическая область оказывают четко выраженное тормозное влияние на поведение и синхронизируют ЭКоГ.
Большинство авторов сходится на том, что эффекты раздражения РФ сильнее выражены на ЭКоГ, а эффекты стимуляции гипоталамуса — в поведении и в электрической активности лимбических структур.
Особое значение в обеспечении бодрствующего состояния играет диффузная и специфическая таламические системы. Так, например, ряд авторов показали, что десинхронизация ЭЭГ и поведенческая активация связаны с высокочастотным раздражением неспецифических ядер таламуса, в то время как низкочастотная их стимуляция приводит к синхронизации ЭЭГ с явлениями поведенческого сна. В связи с этим предполагается существование в мозговых структурах двух раздельных физиологических механизмов с разными путями их влияния на кору и с разными их функциональными характеристиками. Предполагается, что высокочастотное раздражение интраламинарных ядер таламуса осуществляется через восходящую систему, т. к, перерезки на пре- и мезенцефалическом уровнях устраняли такую активацию. Видимо, такое влияние на уровень бодрствования может оказывать высокочастотное раздражение всех уровней РФ — от продолговатого мозга до таламуса и даже новой коры включительно. Низкочастотное раздражение этих отделов мозга вызывает синхронизацию ЭЭГ и явления сна (рис. 2, табл. 1).
Таблица 1. Физиологические и электрографические эффекты, возникающие при раздражении мозговых структур, принимающих участие в регуляции уровня бодрствования и глубины сна (по Шеповальникову, 1971)
| Область мозга, название стимулируемой структуры | Применяемая стимуляция | Наблюдаемый эффект | Литературный источник |
| Мезенцефальная часть ретикулярной формации | Высокочастотная Низкочастотная | Десинхронизация, пробуждение Синхронизация, сон | Moruzzi, Magoum, 1949 Favale et al., 1961 |
| Бульбарный синхронизирующий центр | То же | Синхронизация, подавление, влияния восходящей активирующей ретикулярной формации (?) | Batitni et al., 1959; Moruzzi, 1962; 1964; Нарикашвили и др., 1965 |
| «Добавочный» бульбарный центр синхронизации | — | Синхронизация; частичное подавление эффектов возбуждающей активирующей системы | Bonvallet, Dell, 1965 |
| «Базальная синхронизирующая система» | Любой частоты Кристаллик ацетилхолина | Синхронизация; сон То же | Clemente, Sterman, 1962, 1963 Hernandez—Peon, 1965, 1967 |
| Таламус | Низкочастотная Высокочастотная То же | Рекруитирующая реакция, сноподобное состояние Десинхронизация, пробуждение Синхронизация или десинхронизация (в зависимости от интенсивности стимуляции) | Dempsey, Morison, 1942 Schlag, Chaillet, 1963 Angyan, 1970
|
| Дорсо-медиальная центральная часть Варолиева моста — «центр парадоксального сна» | — | Десинхронизация, не сопровождающаяся пробуждением | Jouvet, 1963, 1965, 1969 |
| Базальные узлы | — | Угнетающий эффект на восходящую активирующую ретикулярную формацию | Clemente, Sterman, 1962 |
| Гиппокамп | — | То же | Hernandez—Peon, 1963 |
| Гипоталамус | — | Активирующий эффект на кору больших полушарий Альтернирующий эффект (в зависимости от общего состояния) | Анохин, 1962; Tokizane, 1965 Parmeggiani et al., 1968 |
| Неокортекс | Высокочастотная
Низкочастотная | Активация ретикулярной формации ствола Угнетение ретикулярных активизирующих влияний, сон | Dell et al., 1961 Hugelin, Bonvallet, 1957, 1958; Rossi, Zanchetti, 1967 |
Наконец, еще одной системой, участвующей в осуществлении реакции пробуждения, является лимбическая система. Одним нз электрографических компонентов реакции пробуждения в этом случае является появление синхронизированного гиппокампального θ-ритма. В экспериментах многих авторов было показано, что частота гиппокампального θ-ритма довольно характерно отражает уровень бодрствования. При этом частота его увеличивается от 4—6 кол/с, при спокойном бодрствовании, до 9—11 кол/с, при выработке условного рефлекса. Интересно, что при условнорефлекторном поведении частота θ-ритма даже несколько выше, чем при активации, вызванной применением болевого раздражения.
Последнее обстоятельство, а также тот факт, что в гиппокампе найдено довольно много нейронов — «детекторов новизны», позволяет предполагать, что лимбическая система осуществляет свою активирующую функцию в ответ на изменение окружающей обстановки, особенно если это связано с определенным эмоциональным состоянием.
Деятельность гипоталамической активирующей системы связана с удовлетворением основных физиологических потребностей организма (голода, жажды и т. п.). В соответствии с этими потребностями она регулирует смену сна и бодрствования и уровень корковой активности.
Роль ретикулярной активирующей системы, по-видимому, состоит в поддержании общего тонуса коры, необходимого для полноценного информационного анализа афферентной импульсации.
Каковы же механизмы реакции пробуждения в какое состояние коры она отражает?
Известно, что процессы высшей нервной деятельности осуществляются на фоне бодрствования. Поэтому предполагается, что реакция пробуждения в ЭЭГ должна быть связана с повышением возбудимости коры, повышением уровня ее активности.
И действительно, ряд фактов показывает, что при раздражении ретикулярной формации улучшается зрительное различение, повышается возбудимость моторной коры, облегчаются первичные ответы в зрительной коре и циклы их восстановления и т. д.
Однако были получены и противоположные данные. Так, А. Б. Коганом (1958) было показано, что эраузал- реакция в коре кошки в условиях свободного поведения сопровождается возрастанием порогов возбуждения к прямому электрическому раздражению корковых структур. Было сделано заключение, что эраузал-реакция может свидетельствовать и о тормозном состоянии коры. Такая точка зрения нашла подтверждение и в работах других исследователей. Исследования активности одиночных нейронов коры показали, что различия между бодрствованием и сном заключаются лишь в распределении разрядов во времени, но не касаются частоты разрядов. При эраузал-реакции прерывистый, сгруппированный разряд нейронов, сменяется относительно постоянными разрядами (Creutzfeldt, Jung, 1961). Эвартс (Evarts, 1961) связывает бодрствование со сниженной спонтанной активностью большинства нейронов коры. Однако А. Б. Коган (1970) убедительно показал, что при эраузал-реакции можно обнаружить нейроны как учащающие, так и замедляющие свою активность.
По данным лаборатории А. Б. Когана при эраузал-реакции пропорция возбуждающихся и тормозящихся нейронов коры приближается к 2 : 1, причем большинство возбуждающихся нейронов находится в I—IV слоях коры, а затормаживающихся в V—VI слоях. Таким образом, по этим данным эраузал-реакция отражает не диффузное возбуждение коры, а активацию сенсорных и угнетение моторных нейронных элементов. Отсюда становятся понятными данные о повышении порогов вызова двигательных реакций при прямом раздражении коры, во время эраузал-реакции, о чем мы говорили выше. Однако А. Б. Коган отмечает (1971), что такое распределение возбужденных и заторможенных нейронов во время эраузал-реакции во многом зависит от ряда факторов— свойств афферентного раздражителя, его сигнального значения.
В работах и других многочисленных исследователей (Ricci et al., 1957; Fuster, 1961; Нарикашвили с соавторами, 1965; Ильюченок с соавторами, 1971; Loino, Mollica, 1962; Krupp, Monnier, 1964, и др.) было показано, что при раздражении РФ имеют место лишь разные соотношения в возбуждении и торможении нейронов коры. Эти соотношения зависели от параметров раздражающих импульсов: при низких частотах преобладали тормозные эффекты, при высокой — возбудительные.
Что касается природы торможения импульсной активности коры при раздражении РФ, то этот вопрос еще не совсем ясен.
Так, Клее и др. (Klee et а!., 1964) нашли, что в этом случае наблюдается рост мембранного потенциала нейрона на 2—8 мВ. Такой рост поляризации может быть связан с тем, что вследствие деполяризации пресинаптических аксо-дендритных волокон в коре снимается по механизму конкурентной блокады топическое деполяризующее влияние ретикулярной импульсации на дендриты корковых
нейронов. Авторы также полагают, что может быть и другой механизм торможения — суммация реполяризационных фаз аксо-дендритных постсинантических потенциалов.
Пурпура (Purpura, 1959). В. Г. Скребицкий и О. З. Бомштейн (1967) придерживаются противоположной точки зрения, полагая, что ретикулярное торможение корковых нейронов осуществляется через вставочные нейроны коры.
Не исключено, хотя и крайне проблематично, что торможение корковых нейронов может быть связано с пресинантическим торможением аксонов, идущих к данному нейрону.
Эти и ряд других фактов заставляют полагать, что эраузал-реакция может, видимо, отражать самые различные функциональные состояния коры, различную степень возбуждения и торможения ее нейронов и нейронных ансамблей, а также различных систем мозга. Видимо, для более точной оценки этих состояний в каждом случае необходимо использовать специальные тесты (Jouvet, 1961; Коган, 1970 и др.).
Многочисленными исследованиями в лабораториях П. К. Анохина также показано, что одна и та же по внешним проявлениям десинхронизация ЭЭГ может отражать самые разнообразные активированные состояния организма (ориентировочная реакция, боль, голод и т. д,). Видимо, активация ЭЭГ в разных случаях обеспечивается активностью различных подкорковых образований.
Если эраузал-реакция связана с «десинхронизацией», разрушением или угнетением ранее синхронизированной активности, то необходимо вновь вернуться к механизмам синхронизированных ритмов. В качестве примера возьмем наиболее изученный ритм сонных веретен. В гипотезе Андерсена и Экклса механизм разрушения веретенообразной вспышки, т. е. десинхронизации активности таламических клеток практически не рассматривался. К настоящему времени накопился ряд экспериментальных фактов, позволяющих предполагать, что одной из причин такой десинхронизации может являться фоновая возбуждающая синаптическая бомбардировка. Подтверждением этому служат следующие факты; 1) в изолированном таламусе ритмическая активность с частотой 8—12 кол/с регистрируется почти непрерывно, напоминая по форме α-ритм человека (Callaway et al., 1966); 2) при перерезке афферентных путей соматического релейного ядра таламуса в нем и в соответствующей проекционной зоне коры мозга возникает продолжительная непрерывная ритмическая активность (Andersson et al., 1964); 3) аналогичный эффект регистрируется в ЛКТ и зрительной коре при обратимой ишемии сетчатки (Andersson et al., 1971); 4) при удалении или обратимом выключении проекционных областей коры в соответствующих таламических ядрах возникает синхронизированная ритмика (Нарикашвили, 1968, и др.)
Поскольку снятие афферентной бомбардировки ведет к облегчению синхронизации, в норме она, по-видимому, эту синхронизацию разрушает. Следует отметить, что синхронизация и десинхронизация могут развиваться локально в связи с активностью как специфических, так и неспецифических образований.
Наличие фоновой возбуждающей бомбардировки во время веретенообразной вспышки в таламусе, по-видимому, приводит к тому, что некоторые нейроны могут разрядиться несколько раньше, чем на них полностью закончится очередной ТПСП. Через систему тормозных вставочных нейронов они вызовут новый ТПСП на тех клетках, на которых предыдущий ТПСП еще не закончился, что приведет к частичной суммации ТПСП, развитию топической гиперполяризации и торможению импульсной активности значительного числа нейронов (Andersen, Sears, 1964; Waszak, 1972; Гусельников с соавторами, 1973). Поскольку импульсная активность сохраняется только у сравнительно небольшой группы наиболее деполяризованных клеток (Andersson, Manson, 1971), десинхронизация их активности за счет фоновой бомбардировки наиболее вероятна.
Развитие тонического гиперполяризационного сдвига может быть обусловлено и другими причинами. Например, пресинаптическим внутриталамическим торможением или тоническим тормозным влиянием из ретикулярного ядра таламуса (Schlag, Waszak, 1971),
Возможна также активная блокада синхронизированной ритмики за счет торможения интернейронов со стороны активирующих систем. Так, Пурпура и Шофер (Purpura, Shofer, 1963) показали, что при смене низкочастотного раздражения медиального таламуса на высокочастотное, ТПСП, ранее возникавшие в других таламических ядрах, исчезают, а сохраняются только ВПСП на каждый стимул. Поэтому авторы предположили, что при активации РФ избирательно тормозятся тормозные интернейроны. Поскольку неизвестно точно, какие именно клетки выполняют функции тормозных интернейронов, проверить это предположение экспериментально довольно сложно. Высказывалось предположение (М, Scheibel, A. Scheibel, 1967; Schlag, Waszak, 1971), что тормозными элементами могут быть клетки ретикулярного ядра таламуса. Действительно, по ряду электрофизиологических свойств они подходят на роль тормозных интернейронов. Во время реакции вовлечения они разряжаются высокочастотными пачками спайков, которые по времени совпадают с торможением нейронов других таламических ядер. При высокочастотной стимуляции РФ эти клетки тормозятся. Однако даже в небольшом участке таламуса после обширных разрушений других ядер, в том числе и ретикулярного, веретенообразная активность сохраняется (Andersen, Andersson, 1968). Так что и ретикулярные таламические нейроны не обязательны для поддержания синхронизации.
Близкую точку зрения на механизм ретикуло-кортикальной активации высказал А. Я. Супин (1968). Он полагает, что в основе ретикуло-кортикальной активации (угнетение «-подобного ритма у животных) лежит не возбуждение кортикальных нейронов и десинхронизация их работы, а блокада тормозных механизмов таламуса и коры (торможение тормозных интернейронов).
Следует отметить, что и на фоне ретикулярной активации синхронизация может возникать как естественным путем (только очень локально), так и искусственным образом. Естественно, пороги вызова синхронизации сильно зависят от степени активации (от силы ретикулярной стимуляции или от уровня бодрствования). Так, даже в состояниях активного бодрствования и в парадоксальном сне можно вызвать реакцию вовлечения (Ройтбак и Эристави, 1965). Бухвальд и сотрудники (Buchwald et al., 1961) на фоне высокочастотного раздражения мезенцефалической РФ вызывали у бодрствующих кошек «веретена хвостатого ядра».
Таким образом, наличие синхронизации ЭЭГ или ее отсутствие, т. е. десинхронизация, зависят, видимо, от соотношения активирующих (десинхронизирующих) и тормозных (синхронизирующих) влияний.
Цикл сон — бодрствование и изменение ЭЭГ
В первых электроэнцефалографических работах было отмечено, что переход человека или экспериментального животного из состояния бодрствования в состояние сна и обратно приводит к характерным изменениям электрической активности мозга. В наиболее общем виде эти изменения можно описать следующим образом: во время бодрствования в ЭЭГ преобладают быстрые низкоамплитудные нерегулярные колебания, а во время сна — медленные высокоамплитудные волны, часто следующие в виде регулярного ритма.
Существует несколько классификаций изменений ЭЭГ человека в цикле сон — бодрствование. Наиболее распространенными являются классификации Лумиса с соавторами (Loomis et al., 1937), Девис с соавторами (Davis et al., 1938) и Демента и Клейтмана (Dement, Kleitman, 1957).
По Девис (1938) на электроэнцефалограмме можно выделить 6 основных стадий в цикле сон—бодрствование: θ-стадия — соответствует напряженному бодрствованию и характеризуется низковольтной, быстрой и нерегулярной ЭЭГ.
Стадия А (I) — соответствует спокойному бодрствованию и характеризуется доминированием α-ритма.
Стадия В (II)—соответствует дремотному состоянию и поверхностному сну. Она характеризуется исчезновением α-ритма, т. е. «уплощением» ЭЭГ и появлением нерегулярных медленных волн в θ- или δ-диапазоне. Нередко эта стадия по ЭЭГ очень напоминает С-стадию.
Стадия С (III)—соответствует сну средней глубины. Для нее наиболее характерно появление на фоне нерегулярных θ- и δ-волн и вспышек сонных веретен с частотой 12—18 кол/с.
Стадия D (IV)—характеризуется регулярной 6-активностью с частотой 2—4 кол/с и резким сокращением числа сонных веретен.
Стадия Е (V) — медленные 0,5—1 кол/с высокоамплитудные волны при полном отсутствии веретен.
Последние две стадии (D и Е) отражают наступление глубокого сна.
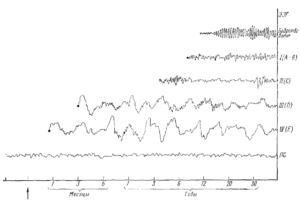
Классификация стадий сна по Лумису и др. показана на рис. 3. На этом же рисунке показано формирование ЭЭГ — стадий сна в онтогенезе человека.
В связи с открытием и описанием так называемой парадоксальной фазы сна Демент и Клейтман (Dement, Kleitinan, 1957) предложили следующую классификацию ЭЭГ-проявлений сна:
I стадия—низковольтная быстрая активность, иногда включающая короткие вспышки a-волн (соответствует стадии В по Девис, т. е. дремоте),
II стадия— появление сонных веретен на фоне уплощенной ЭЭГ,
III стадия — сонные веретена и медленные высокоамплитудные волны,
IV стадия — еще более медленные δ-волны без веретен.
Стадия сна с быстрыми движениями глаз (БДГ) — по ЭЭГ проявлениям похожа на стадию I.
Современные классификации в целом придерживаются такой же схемы, но отдельные стадии сна часто подразделяются на более мелкие подстадии по наличию или степени выраженности тех или иных ЭЭГ-компонентов (например, стадия В делится на подстадии В1—B6 по Латашу (1968); стадия «быстрого» сна на стадию с БДГ и без БДГ и т, и.).
Аналогичное описание ЭЭГ-изменений в цикле сон — бодрствование было сделано и у экспериментальных животных: крыс, кошек, обезьян. При этом основные закономерности, обнаруженные у человека, подтвердились. У животных стандартными критериями наступления фазы «быстрого» парадоксального сна являются: десинхронизация ЭКоГ, появление гиппокампального θ-ритма, полное исчезновение тонуса шейных мышц и быстрые движения глаз, а также подергивания конечностей, ушей, вибрисс.
Уже к середине 50-х годов были получены главные факты относительно роли блокады восходящих влияний от ретикулярной активирующей системы, расположенной в каудальной и средних отделах мозгового ствола и одновременного реципрокного активирования так называемых синхронизирующих механизмов в возникновении сна.
Позже, в результате экспериментальной разработки было выяснено, что десинхронизирующие и синхронизирующие механизмы представлены фактически на всех уровнях мозговой оси,
К настоящему времени мозговой аппарат управления бодрствованием и сном можно представить в виде очень сложной многочленной и многоуровневой организации, подробное описание которой заняло бы значительное место. Мы коснемся этого вопроса лишь схематично.
Как мы уже говорили, неспецифическая таламическая система оказывает не только активирующее действие на кору больших полушарий, но при низкочастотном электрическом раздражении (особенно интраламинарных ядер таламуса) вызывает развитие сна у животного (Akert et al., 1952; Proctor et al., 1957, и др.).
Таким образом, таламо-кортикальная система вызывает синхронизирующий эффект в коре больших полушарий и действует как антагонист восходящей активирующей ретикулярной системы.
Моруцци (1962) приводит экспериментальные данные о наличии в нижних отделах ствола мозга еще одних синхронизирующих структур, действующих как антагонисты восходящей активирующей ретикулярной системы. Эта синхронизирующая бульбарная система расположена, видимо, в области солитарного тракта. Несколько латеральнее и оральное этих структур, а также в области солитарного тракта Бонвалле и Деллом (Bonvallet, Dell, 1965) найден еще один, «дополнительный» синхронизирующий центр, который, видимо, также участвует в подавлении неспецифической восходящей активирующей системы. Таким образом, блокада активирующих влияний РФ ствола в сочетании с включением синхронизирующих влияний от таламуса и синхронизирующих систем продолговатого мозга является главным условием для наступления сна. Низкочастотное раздражение почти всех пунктов РФ (область среднего мозга, моста, продолговатого мозга) вызывает появление медленных высокоамплитудных колебаний и сонное состояние.
В то же время необходимо отметить, что раздражение одного и того же пункта РФ может вызвать пробуждение или сон в зависимости от характера стимуляции и состояния животного (Rossi, 1963; Rossi et al., 1964).
Однако есть область мозга, при любой стимуляции которой возникает только, синхронизирующий эффект. Это так называемая «базальная синхронизирующая область» (см. рис. 3), расположенная в преоптической зоне у самого основания перегородки. Она имеет связи с мостовым центром парадоксального сна и синхронизирующим механизмом продолговатого мозга (Clemente, Sterrnan, 1963; Hernandez—Peon, 1967).
Значительную роль в регуляции цикла сон — бодрствование играют различные отделы гипоталамуса (Анохин, 1968; Parmeggiani, 1968; Баклаваджян, 1967, 1969 и др.), а также хвостатое ядро, электрическое раздражение которого вызывает как появление σ-ритма в коре, так и поведенческое торможение (Buchwald et al., 1961).
Угнетающее влияние на «пробуждающие» ретикулярные структуры осуществляет не только гипоталамус и хвостатое ядро, но и гиппокамп (Анохин, Судаков, 1970; Parmeggiatii, 1960; Nauta; 1958, и др.).
В последнее время все большая роль в регуляции сна и бодрствования придается самой коре больших полушарий; накоплен огромный материал, показывающий решающую роль коры в регуляции подкорковых центров сна и бодрствования.
Таким образом, при электрическом раздражении очень многих структур мозга возникает сон, особенно если снимается кортико-фугальный контроль. «Однако без участия коры больших полушарий и включения всех нейрохимических и гуморальных механизмов простое взаимодействие «десинхронизирующих» и «синхронизирующих» структур мозга не может вызвать целостной картины сна как приспособительного фактора организма».
Значительный прогресс в изучении природы сна связан с исследованием парадоксальной стадии сна или стадии REM (rapid eye movement, или ВДГ). Парадоксальным этот тип сна назван в связи с активированным состоянием ЭЭГ. Он связан, как правило, со сновидениями. Многочисленные опыты разных исследователей и особенно лаборатории Жуве и сотрудников (Jouvet et al., 1961, 1967, 1969) показали, что структуры, ответственные за парадоксальный сон, локализованы позади предмостовой перерезки — в области моста и покрышки моста (рис. 2, 6). Эта данные, подтверждаются опытами с электрическим раздражением и коагуляцией этих структур. Однако механизм, запускающий парадоксальный сон, не ограничивается мостом, — он может быть активирован при высокочастотном раздражении среднемозговой ретикулярной формации и низкочастотным раздражением гипоталамуса и гиппокампа. Парадоксальный сон, видимо, тесно связан и с вестибулярным аппаратом.
Причинами явления десинхронизации ЭЭГ во время парадоксального сна считают эмоции при сновидениях (Мэгун, 1965) или диссоциацию различных восходящих активаций, или гиперкапнию восходящей ретикулярной формации в связи с выключением синхронизирующего механизма в каудальном отделе ствола мозга.
Ряд исследователей усматривают определенное единство медленного и парадоксального сна (Hernandez—Peon, 1965; Moruzzi, 1963, и др.), в то же время как Жуве (Jouvet, 1967) на основании филогенетических исследований полагает, что существуют специальные механизмы для парадоксального и для медленного сна.
Таким образом, даже из этого краткого обзора становится ясно, что изменения медленной электрической активности мозга во время цикла сон — бодрствование обусловлены взаимодействием многих систем мозга, интегративная деятельность которых крайне сложна и многообразна. Она становится еще более сложной при различных направленных воздействиях на организм, а также при сложных формах условнорефлекторной деятельности. Именно поэтому изучение тонких механизмов изменений суммарной активности мозга в цикле сон — бодрствование приобретает особо важное значение для понимания функциональной электроэнцефалографии.
Несколько слов о нейронной активности в цикле сон — бодрствование. Исследование активности одиночных нейронов показало, что во сне отнюдь не происходит разлитого торможения нейронной активности. Скорее следует говорить об ее существенной перестройке. Нейронная активность в периферических отделах анализаторов, т. е. ниже таламического уровня, практически-не зависит от уровня бодрствования (Mukhametov, Rizzolatti, 1970). На таламо-корковом уровне средняя частота разрядов клеток, измеряемая числом импульсов в секунду, у большинства нейронов изменяется однотипно. Если принять среднюю частоту при бодрствовании за 100%, то в медленноволновом сне она несколько снижается, примерно до 50—80%, а в парадоксальном сне достоверно увеличивается до 120—150%. Наиболее заметны изменения рисунка импульсной активности. В состояниях бодрствования и парадоксального сна нейроны, как правило, разряжаются одиночными спайками с различной частотой. По мере углубления медленноволнового сна частота разрядов снижается и они начинают группироваться в плотные пачки импульсов, разделенные длительными паузами, Частота разрядов внутри пачек достигает 200—500 в 1 с (т. е. близка к максимально возможной). Активность такого вида одинаково свойственна как различным отделам коры, так и различным таламическим ядрам у большинства экспериментальных животных.
Изучение нейронной активности во время сна, как спонтанной, так и вызванной, не говорит о снижении активности коры и подкорковых образований. Наоборот, наблюдается повышение уровня возбудимости коры и ряда подкорковых структур во время сна и особенно в фазе парадоксального сна. Таким образом, известная точка зрения на сон как состояние сниженной активности ЦНС не подтверждается.
Интересные данные, касающиеся нейронной активности латерального коленчатого тела в цикле сон —бодрствование, получил Л. М. Мухаметов с соавторами (Мukhametov, Rizzolatti, 1970). Они исследовали спонтанную активность клеток и их ответы на диффузный засвет сетчатки. Оказалось, что возбуждающий для данной клетки стимул приводит к сдвигу рисунка импульсной активности в сторону бодрствования или менее глубокой стадии сна, а тормозной стимул — в сторону более глубокой фазы медленно-волнового сна.
Происхождение высокочастотных пачек импульсов во время медленно-волновых стадий сна пока окончательно не выяснено. Однако такие пачки возникают на «гигантских» ВПСП, которые можно зарегистрировать в медиальном таламусе при ритмической стимуляции специфического ядра в том случае, если стимул приходится на концевую часть предшествующего ТПСП (Desiraju, Purpura, 1970). Аналогичные гигантские ВПСП были зарегистрированы у нейронов таламуса крысы на фоне гиперполяризационного сдвига во время веретенообразных вспышек (Гусельников с соавторами, 1973). Создается впечатление, что для возникновения таких «экзальтированных» ВПСП с пачками спайков необходима фоновая гиперполяризация. Если это предположение подтвердится, можно полагать, что во время медленноволнового сна в нейронах таламуса и коры развивается тоническая гиперполяризация, которая и обусловливает характерный рисунок импульсации.
Подобные постсинаптические потенциалы в ответ на вспышку света были зарегистрированы в латеральном коленчатом теле кошки (Ilwvain, Creutzfeldt, 1967) и в зрительной коре кролика (Скребицкий, 1972). В целом
внутриклеточные регистрации показали, что на таламокорковом уровне в состоянии бодрствования, т. е. при десинхронизации ЭКоГ, в нейронах регистрируются преимущественно низкоамплитудные ВПСП с одиночными спайковыми разрядами. Спонтанные ТПСП наблюдаются очень редко. При синхронизации ЭКоГ появляются спонтанные ТПСП, а также высокоамплитудные ВПСП с пачками спайковых разрядов,
В связи с тем, что синхронизация ЭЭГ коррелирует с развитием тормозного состояния (сонное торможение), а десинхронизация ЭЭГ с поведенческим возбуждением и бодрствованием, заманчиво предположить, что механизмы поведенческого торможения и механизмы синхронизации ЭЭГ тесно связаны между собой, Еще И. П. Павлов предполагал, что сон и условное (внутреннее) торможение представляют собой один и тот же процесс. Поэтому ряд исследователей изучали связь между различными проявлениями поведенческого торможения, особенно условнорефлекторного поведения, и синхронизацией ЭЭГ.
Как правило, развитие синхронизированной ритмической электрической активности в коре и подкорковых структурах мозга происходит во время медленноволновых стадий сна. Однако и при общем бодрствующем состоянии животных в ряде экспериментальных ситуаций тормозное поведение коррелирует с синхронизацией электрической активности. Так, многие исследователи обнаружили, что при наличии корковой синхронизации (т. е. веретен, медленных волн или тех и других) предъявление положительного условного раздражителя не вызывает поведенческого ответа. Тормозный же раздражитель может провоцировать, развитие синхронизации. Синхронизация ЭЭГ описана во время предъявления условного раздражителя при угашении (Кратин, 1967), при подаче неподкрепляемого дифференцировочного раздражителя при выработке классического и инструментального условного рефлекса, во время отставленного торможения во время предъявления раздражителя после привыкания к нему, при пищевом насыщении, при получении пищевого подкрепления, при торможении двигательной активности, а также и в других ситуациях, характеризующихся поведенческим торможением. Все эти данные позволяют предполагать, что между нервными процессами, лежащими в основе синхронизации электрической активности мозга, и механизмами поведенческого торможения существует тесная взаимосвязь.
Однако в поведенческих экспериментах далеко не всегда производилась четкая идентификация ЭЭГ — феноменов, коррелировавших с тем или иным видом поведенческого торможения. Так, как правило, не делалось различия между медленными волнами и веретенами, на что указывает Жуве (Joiivet, 1967). В литературе нет единого представления о свойствах и механизмах α-подобной ритмики, неясно ее соотношение с ритмом сонных веретен (Jasper, 1949; Bremer, 1958; Andersen, Andersson, 1968). Иногда вся «не десинхронизированная» активность рассматривалась как единое целое (Weinberger et al., 1967). Такое положение, естественно, чрезвычайно затрудняет поиск четких электрографических коррелятов тормозных поведенческих состояний, а также нейрофизиологический анализ механизмов поведенческого торможения.
В связи с тем, что из всех видов синхронизированной ритмики наиболее изучены механизмы ритма сонных веретен, значительный интерес с точки зрения нейрофизиологического анализа механизмов поведенческого торможения представляют такие эксперименты, в которых поведенческое торможение коррелировало бы с развитием веретенообразной ритмики.
Наиболее показательными в этом отношении являются опыты, в которых прослеживались пороговые соотношения между возникновением веретенообразной активности и развитием поведенческого торможения. Прежде всего, к ним относятся эксперименты с искусственной провокацией сна путем низкочастотной электростимуляции ряда структур мозга, которая продуцирует корковую реакцию вовлечения (Parmeggiani, 1962; Гусельников, Мухаметов, 1967, 1969; Jouvet, 1967).
Далее, пороговые соотношения наблюдаются между «веретенами хвостатого ядра» и торможением условно- рефлекторных движений. Бухвальд с соавторами показали (Buchwald et al., 1961, 1967), что такие соотношения сохраняются у кошек даже на фоне искусственной активации, вызванной высокочастотной электростимуляцией мезенцефалической РФ. При этом происходит торможение только условнорефлекторных движений, а наличная двигательная активность животных не нарушается. Аналогичные результаты на кошках получил Ракич (Rakic, i960) и на обезьяне Китсикис и др. (Kitsikis eta]., 1966). Надо сказать, что при стимуляции хвостатого ядра человека Ван Бурен и др. (Van Buren et al., 1966) также наблюдали задержку речевого ответа и неспособность выполнить простые движения рукой. Однако в этих опытах не были зарегистрированы веретена хвостатого ядра. Несмотря на то, что тормозному влиянию хвостатого ядра на поведение посвящено большое число оригинальных работ и обзоров (Черкес, 1963, 1969; Laursen, 1963; Divak, 1968; Арушанян, 1972, и др.), механизмы этого торможения пока почти неизвестны. Можно только предположить, что определенную роль здесь играет и механизм вызванных веретен.
Пороговые соотношения наблюдаются также между вызванными вспышкой света ритмическими послеразрядами в зрительной системе крыс и торможением условно- рефлекторной деятельности (Klingberg, Pickcnhain, 1965). Неясно, однако, каков механизм этих послеразрядов, в частности, являются ли они аналогом α-подобного ритма или вызванными веретенами в зрительной системе.
Наконец, разрушения или обратимое холодовое выключение некоторых структур мозга, ведущие к полному устранению из корковой ЭЭГ различных модификаций ритма сонных веретен (Skinner, Lindsley, 1967; Skinner, 1971), вызывают дефицит торможения, который выражается, в частности, в невозможности выработки дифференцировок.
Эти факты позволяют высказать предположение, что поведенческое торможение (сон, торможение условных рефлексов) может являться результатом запуска таламического механизма синхронизированной веретенообразной ритмики (Jouvet, 1967; Bremer, 1970; Гусельников, Мухаметов, 1969). При этом поведенческое торможение может быть связано с: а) блокадой проведения афферентной импульсации через таламические релейные ядра или с разрушением информационной структуры этих афферентных залпов во время веретенообразной вспышки; б) блокадой переработки межцентральной информации на уровне коры, таламуса, гипоталамуса, хвостатого ядра и других отделов мозга; в) нисходящими тормозными (или дискоординируюшими) влияниями механизма ритма сонных веретен на спинной мозг, т. е. с нарушением целостности рефлекторной дуги на любом из ее участков. Для экспериментальной проверки этих предположений требуются специальные опыты, так как прямых доказательств данной гипотезы практически нет.
Не исключено также, что как поведенческое торможение, так и синхронизация электроактивности мозга между собой причинно не связаны, так как наряду с описанными корреляциями между поведенческим торможением и синхронизацией ЭЭГ существует немало работ, в которых подчеркивается диссоциация между поведением и ЭЭГ. Это, прежде всего, описание «парадоксальной» фазы сна, для которой характерны ЭЭГ-феномены бодрствования, т. е. десинхронизация ЭКоГ. Обратная диссоциация описана у кошек при депривации сна: при внешне бодрствующем животном ЭЭГ напоминает сонную (веретена или медленные волны) (Ferguson, Dement, 1967).
Вайнбергер и др. (Weinberger et al., 1967) не обнаружили корреляции между синхронизацией ЭЭГ и поведенческим торможением при выработке дифференцировки на зрительные стимулы. Ю. Г. Кратки (1967) также обнаружил, что при действии дифференцировочного стимула, не вызывающего ответной реакции животного, в ЭКоГ слуховой и моторной областей регистрируется десинхронизация. С другой стороны, предъявление положительного сигнала дремлющему животному вызывало синхронизацию— вспышку α-ритма в коре. В результате был сделан вывод, что синхронизация или десинхронизация ЭКоГ отражает только общее функциональное состояние организма — уровень бодрствования. При этом результат действия того или иного раздражителя зависит не только от его качества, но и от исходного функционального состояния животного.