Активность одиночного нейрона (англ. single unit activity, SUA) — последовательность потенциалов действия отдельного нейрона. Как правило регистрируется с помощью микроэлектродов расположенных рядом с нейроном (внеклеточная регистрация) или запись одиночного нейрона (англ. single unit recording, SUR), но также часто относят и внутриклеточную регистрацию, которая выделяется отдельно, как метод patch clamp.
➥ Более подробно: Микроэлектродный метод измерения мембранного потенциала
В начале 1950, внеклеточные, методы регистрации одиночных нейронов были использованы для получения большого количества данных о свойствах структур центральной нервной системы (ЦНС). Внеклеточные микроэлектроды использовались для отображения электрической активности одиночных нейронов, чтобы ответить на фундаментальные вопросы о возбудимости дендритов ЦНС, а позднее они были использованы для изучения поведенчески связанных паттернов нейронов у бодрствующих животных. Метод записи активности одиночных нейронов на данный момент является методом выбора.
Принцип метода
В основе записи активности одиночных нейронов лежит регистрация их электрической активности.
Внеклеточные поля одиночных нейронов
Амплитуда и длительность спайков одиночных нейронов
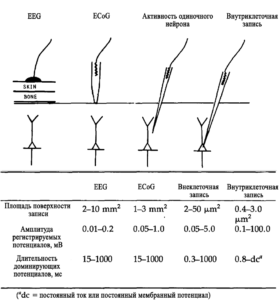
Единичные спайковые потенциалы значительно короче по длительности и, в среднем, больше по амплитуде, чем потенциалы, которые регистрируются с поверхности или в глубинах мозга с помощью макроэлектродов. Одна из причин таких различий в амплитуде заключается в том, что наибольшие потенциалы, генерируемые нейроном, будут находиться в непосредственной близости от места изменения проводимости мембраны. Для регистрации этих потенциалов в полной амплитуде необходим электрод, диаметр конца которого меньше по сравнению с размерами самой крутой части внеклеточного потенциального поля активного нейрона. Для кортикальных нейронов эти размеры могут быть порядка 20 мкм. Концы электродов, приближенные к этому значению, размещенные рядом с небольшим активным нейроном могут представлять собой изопотенциальную поверхность, которая эффективно “замыкает” потенциальное поле клетки.
Конфигурация и полярность спайков
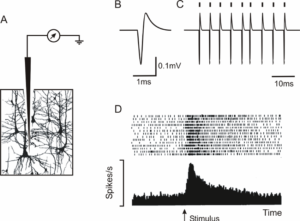
В отличие от внутриклеточно регистрируемых потенциалов действия, внеклеточные спайки могут заметно различаться по конфигурации и даже по полярности, в зависимости от геометрии клетки и расположения регистрирующего электрода. Во многих случаях такие вариации мало интересуют исследователя, и единственное, что представляет интерес – это появление вызванного спайка или некоторого параметра пачек спайков (spike trains). Тем не менее, изменения в форме спайка часто помогают определить размещение микроэлектрода и могут дать ценную информацию о вероятной геометрии и, следовательно, типе клетки (например, пирамидальной или звездчатой формы). 1
Нейронные потенциалы и электроды
Метод регистрации потенциала нейронов зависит от типа используемого электрода. Неполяризуемые электроды являются обратимыми т.е. возникают реакции, противоположные по направлению (ионы в растворе заряжаются и разряжаются). Это создает ток, протекающий через электрод, что позволяет измерять напряжение на электроде с течением времени. Обычно неполяризуемые электроды представляют собой стеклянные микропипетки, заполненные ионным раствором или металлом. Альтернативно, идеальные поляризованные электроды являются необратимыми т.е. на них протекают реакции не обратные друг другу; это обычно металлические электроды.2Вместо этого ионы и электроны на поверхности металла поляризуются относительно потенциала раствора. Заряды ориентируются на границе раздела сред, создавая электрический двойной слой; металл затем действует как конденсатор. Изменение емкости по отношению ко времени может быть измерено и преобразовано в напряжение с помощью мостикового контура.3Когда нейроны формируют потенциал действия, они создают изменения в потенциальных полях, которые могут быть записаны с помощью микроэлектродов.
Оборудование
Для записи активности одиночных нейронов необходимы:
- микроэлектроды;
- усилитель;
- микроманипулятор;
- записывающее устройство.
Микроэлектроды должны быть с тонкими наконечниками и являться низкоимпедансными проводниками;4в основном это стеклянные микропипетки, металлические микроэлектроды из платины, вольфрама, иридия или даже оксида иридия,567тип используемого микроэлектрода будет зависеть от области применения. Высокое сопротивление этих электродов может создавать проблем при усилении сигнала. Если бы он был подключен к обычному усилителю с низким входным сопротивлением, на микроэлектроде было бы большое падение потенциала, и усилитель измерял бы только небольшую часть истинного потенциала. Чтобы решить эту проблему, катодный повторитель усилителя должен использоваться в качестве устройства согласования импеданса для сбора напряжения и подачи его на обычный усилитель. Для записи с одного нейрона необходимо использовать микроманипуляторы, чтобы точно вставить электрод в необходимую область мозга.
Наконец, сигналы должны быть экспортированы на записывающее устройство. После усиления сигналы фильтруются различными методами. Они могут быть записаны осциллографом и камерой, но более современные методы преобразуют сигнал с помощью аналого-цифрового преобразователя и выводят на компьютер для сохранения. Методы обработки данных могут позволить разделение и анализ отдельных нейронов.8
Footnotes
- Extracellular Single-Unit Recording Methods. Neurophysiological Techniques pp 1-8. DOI: 10.1385/0-89603-185-3:1
- Gesteland, R. C.; Howland, B. (1959). “Comments on Microelectrodes”. Proceedings of the IRE. 47 (11): 1856–1862. doi:10.1109/jrproc.1959.287156.
- Robinson, D. A. (1968). “The Electrical Properties of Metal Microelectrodes”. Proceedings of the IEEE. 56 (6): 1065–1071. doi:10.1109/proc.1968.6458.
- Cogan, Stuart F. (2008). “Neural Stimulation and Recording Electrodes”. Annual Review of Biomedical Engineering. 10: 275–309. doi:10.1146/annurev.bioeng.10.061807.160518.
- Cogan, Stuart F. (2008). “Neural Stimulation and Recording Electrodes”. Annual Review of Biomedical Engineering. 10: 275–309. doi:10.1146/annurev.bioeng.10.061807.160518.
- Boulton, A. A. (1990). Neurophysiological techniques: applications to neural systems. Clifton, New Jersey: Humana Press.
- Maeng, Jimin; Chakraborty, Bitan; Geramifard, Negar; Kang, Tong; Rihani, Rashed T.; Joshi‐Imre, Alexandra; Cogan, Stuart F. (2019). “High‐charge‐capacity sputtered iridium oxide neural stimulation electrodes deposited using water vapor as a reactive plasma constituent”. Journal of Biomedical Materials Research Part B: Applied Biomaterials. doi:10.1002/jbm.b.34442
- Thompson, R. F. (1973). Bioelectric Recording Techniques: Part A Cellular Processes and Brain Potentials. New York: Academic Press.