Амантадин рассматривается не только как один из противопаркинсонических препаратов, но и как потенциальное перспективное нейропротекторное средство. Применение амантадина увеличивает продолжительность жизни при болезни Паркинсона(Utti et al., 1996). В настоящее время доказано, что амантадин может блокировать эффекты глутамата, которые усиливаются при снижении ингибирующего воздействия нигростриатной дофаминергической системы, что объясняет функциональный дофаминергический эффект препарата1. Несмотря на высокую информативность методов ЭЭГ, до настоящего времени единичные работы посвящены фармако-ЭЭГ анализу действия антипаркинсонических средств на спектральные характеристики ЭЭГ и особенности перестройки пространственной организации биопотенциалов головного мозга больных БП с применением современных компьютерных методов обработки ЭЭГ. В наших исследованиях было проведено изучение влияния курсового применения амантадина на характер изменений паттерна ЭЭГ и динамику пространственной организации биопотенциалов головного мозга у больных БП. Клиническое исследование проведено у 63 больных БП (40 мужчин и 23 женщины) в возрасте от 42 до 68 лет. Степень тяжести заболевания колебалась от 1 до 4 баллов по шкале Хен-Яра. Диагноз «болезнь Паркинсона» устанавливали в соответствии с международными критериями Банка мозга Общества болезни Паркинсона Великобритании (Gibb W.R.G., Lees A.J., 1988).
Амантадин (ПК-Мерц) назначался ежедневно в течение 10 дней, внутривенно капельно в дозе 200 мг (500,0 мл): у 72% больных в качестве монотерапии; у 28% больных – на фоне дофасодержащих препаратов.
Фармако-ЭЭГ исследование производилось до и после применения амантадин. Регистрация ЭЭГ проводилась в стандартных условиях. Использовались 16-канальный нейрограф «Нейросенсор», работающий на базе IBM-PC 586 и компьютерный комплекс «МБН-Нейрокартограф» научно-медицинской фирмы МБН (Россия). При визуальном анализе оценивались изменение нормальных компонентов ЭЭГ, а также наличие патологических форм активности. Количественный анализ ЭЭГ осуществлялся с помощью программы Brainsys. Для локализации дипольных источников пароксизмальной активности применяли программу Brainloc.
При визуальном анализе ЭЭГ учитывались нарушения основного ритма и наличие патологических знаков. Среди больных БП выделено 4 группы пациентов с различными типами фоновой биоэлектрической активности.
- Пациенты с хорошо выраженным и модулированным α-ритмом, с отчетливыми регионарными особенностями (7 человек – 21,9%). В основном этот тип ЭЭГ наблюдался у больных с акинетико-ригидной формой БП.
- Пациенты с плоским типом ЭЭГ, характеризующейся отсутствием выраженного α-ритма, сглаженностью зональных различий и низкоамплитудной биоэлектрической активностью (6 человек – 18,8%).
- Пациенты с фрагментарным и слабо модулированным α-ритмом (6 человек – 18,8%).
- Пациенты с дезорганизованной биоэлектрической активностью (13 человек – 40,5%), ЭЭГ которых характеризовалась отсутствием региональных различий и была дезорганизована по основному ритму с наличием диффузной быстрой и медленной активности в широком диапазоне частот спектра. Среди них у 5 пациентов – с преобладанием медленной активности, у 8 – с преобладанием быстрой активности (рис. 1).
Показано, что отклонения ЭЭГ от нормы отмечались у 93,75% (30 пациентов). В основном эти различия касались нарушения основного ритма, что выражалось в снижении зональных различий. Наличие пароксизмальной активности в виде синхронных билатеральных групп θ- и/или ß-волн и их комбинаций отмечалось у 11 из 32 пациентов, при этом пароксизмальная активность θ-волн чаще встречалась у больных с дрожательно-ригидной формой БП.
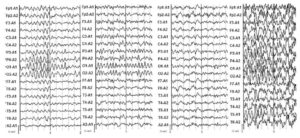

Наличие пароксизмальной активности в виде единичных острых α-подобных волн и/или пиков, а также синхронных билатеральных вспышек групп θ-волн и/или пачек ß-волн отмечалось в той или иной степени у всех исследуемых больных. Пароксизмальная активность в виде групп θ-волн, возникающих синхронно по всем отведениям или в теменно-центрально-затылочных отведениях, чаще встречалась у больных с дрожательно-ригидной формой БП, тогда как пачкообразные разряды ß-активности или пиков превалировали у больных с акинетико-ригидной формой заболевания. Вместе с тем наиболее часто отмечалось сочетанное присутствие вспышек пароксизмальной активности разного характера.
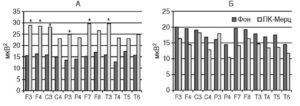
Спектральный анализ биоэлектрической активности мозга больных БП показал, что независимо от формы заболевания, у всех исследованных больных отмечался относительно высокий по сравнению с контролем, индекс α-активности в передних и центрально-височных отделах мозга, что указывает на дисфункцию срединных (таламических) структур мозга (рис. 2).
По данным спектрального анализа биоэлектрической активности мозга больных БП независимо от типа заболевания выделено 2 группы пациентов по степени выраженности ß-ритма. В 1-й группе удельный вес ß2-активности составляет 20-23% от общей мощности спектра и представлен билатерально в обеих гемисферах, межполушарная асимметрия наблюдается в процентном содержании ß1-активности с акцентом в левом полушарии, в показателях мощности спектра в θ-диапазоне правого и левого полушарий достоверных различий не выявлено (рис. 2).
Спектрограммы мощности ЭЭГ 2-й группы характеризовались более низким удельным весом ß2-активности в лобно-центральных, височных и затылочных отделах коры обеих гемисфер независимо от формы заболевания. Кроме того, у больных 2-й группы отмечалась выраженная асимметрия с более высокими показателями мощности спектра ß1-диапазона в височно-теменных отведениях правого полушария. В этой группе больных отмечается выраженная асимметрия и в θ-диапазоне, при этом наиболее четкая асимметрия выявляется у больных с дрожательно-ригидной формой заболевания с акцентом в левом полушарии (рис. 2).
Амантадин оказался наиболее эффективным у больных с акинетико-ригидными формами заболевания, особенно у больных в сочетании с дофа-заместительной терапией. Так, в этой группе больных процент улучшения по всем моторным пробам (проба с постукиванием пальцев, сжимание и разжимание кисти в кулак, пронация-супинация, движения в стопе) превысил 20%. К концу курса инфузионной терапии значительно уменьшилась ригидность в верхних (на 28,5%) и в нижних (на 21%) конечностях. Уменьшилась постуральная устойчивость, чувствительные нарушения.
У всех больных при положительной динамике на фоне лечения амантадином наблюдалось уменьшение пиков и диффузных θ-, ß- и δ-волн, уменьшение ирритативных знаков. Усиление α-активности отмечалось у больных с низкоамплитудной биоэлектрической активностью: появлялись единичные группы α-волн; уменьшалась пароксизмальная активность.
Спектральный анализ биоэлектрической активности мозга больных БП до и после курса инфузионной терапии амантадином позволил выявить определенную связь между степенью коррекции двигательных нарушений и изменениями в спектре мощности ЭЭГ и показателями КОГ. Положительная динамика на фоне лечения амантадином отмечалась у пациентов 1-й группы, выделенной по результатам спектрального анализа фоновых записей ЭЭГ, при этом по сравнению с контролем в височно-теменно-затылочных отведениях левого полушария отмечалось достоверное увеличение мощности спектра в диапазоне ß-активности, тогда как в диапазоне θ-частот отмечалась лишь тенденция к увеличению мощности спектра (рис. 3).
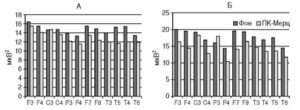
Во 2-й группе применение амантадина не влияло на динамику течения болезни и не было четких изменений в спектре мощности ЭЭГ. Отмечалась лишь тенденция к уменьшению мощности спектра в диапазоне ß-частот в лобных и теменных отделах коры и уменьшению мощности спектра в диапазоне θ-частот во всех исследуемых областях мозга, кроме теменных отделов левого полушария (рис.4).
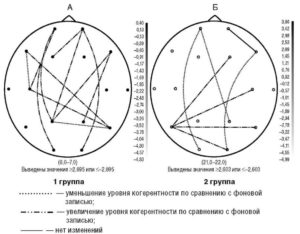
Проведение когерентного анализа ЭЭГ показало, что в группе пациентов с положительной динамикой применение амантадина приводило к нормализации пространственной организации биопотенциалов за счет снижения патологически высоких показателей когерентности для большинства внутри- и межполушарных пар отведений в диапазоне α-, ß- и θ-частот. При этом снижение показателей КОГ достигало значимых различий в диапазоне ß-частот для межполушарных отношений в височно-височных, височно-теменных и височно-затылочных отведениях и интракортикальных длинных связях левого полушария, в θ-диапазоне показатели КОГ достоверно снижались для большинства внутри- и межполушарных пар отведений (рис. 5).
Таким образом, проведенное исследование подтвердило эффективность амантадина у больных как дрожательно-ригидной, так и акинетико-ригидной формой БП. Критериями эффективности проводимой противопаркинсонической терапии могут являться: уменьшение числа залпов осцилляций и повышение амплитуды кривой максимального мышечного напряжения, снижение скорости проведения импульса по двигательным волокнам периферических нервов. Регресс двигательных симптомов коррелировал с изменениями спектрально-когерентных характеристик ЭЭГ в виде улучшения фоновой ЭЭГ, увеличения спектра мощности в диапазоне ß-активности в левой височно-теменно-затылочной области, снижения уровня когерентности в этом же диапазоне и в этой же области, уменьшения выраженности пароксизмальных разрядов.
Определены прогностически значимые показатели спектрально-когерентных характеристик ЭЭГ и пароксизмальной активности для оценки эффективности противопаркинсонических препаратов. Выделение двух групп больных на основании спектрально-когерентного анализа в зависимости от эффективности терапии амантадином позволяет прогнозировать эффект препарата и определяет необходимость проведения ЭЭГ-исследования перед началом лечения.
Проведенное клинико-нейрофизиологическое исследование больных БП выявило однонаправленность нейрофизиологических сдвигов у больных с акинетико-ригидной и дрожательно-ригидной формами заболевания, что свидетельствует о единстве патогенетического процесса.
Критериями эффективности противопаркинсонической терапии на основании исследования биоэлектрической активности головного мозга стали увеличение спектра мощности ЭЭГ в диапазоне ß-активности в левой височно-теменно-затылочной области мозга, снижения уровня КОГ длинных межполушарных височно-теменных, височно-височных, височно-затылочных связей в том же диапазоне и снижение выраженности пароксизмальных разрядов.