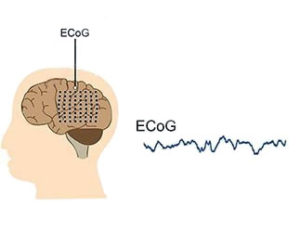
Электрокортикография (англ. electrocorticography; ЭКоГ, ECoG) – это инвазивный способ электрофизиологического мониторинга биоэлектрической активности головного мозга, в основе которого лежит регистрация электрических потенциалов с помощью суперкортикально (эпидурально или субдурально), интракортикально или субкортикально расположенных электродов.
История метода
В 1912 году русские нейрофизиологи В. В. Правдич-Неменский и П. Ю. Кауфман провели фундаментальные экспериментальные исследования, которые показали связь биоэлектрической активности мозга с функциональным состоянием центральной нервной системы: с уровнем бодрствования и глубиной наркоза, с изменениями метаболизма мозга, с воздействием внешних раздражений и даже с экспериментальным судорожным припадком при прямой электростимуляции мозга. Позже они были взяты за основу немецким психологом Г. Бергером при проведении его исследований.1
Впервые регистрация кортикограммы человека была выполнена Г. Бергером в начале 1920-х годов. При хирургическом исправлении дефектов костей черепа он располагал электроды на поверхности коры головного мозга и регистрировал “мозговые волны”.
В начале 1940-х – 1950-х нейрохирург Пенфилд У. Г. и нейрофизиолог Джаспер Г. Г. заложили основы интраоперационной ЭКоГ. Пенфилд У. Г. разработал метод нейрохирургического лечения эпилепсии путем разрушения очагов судорожной активности, представленных соответствующими отделами коры. Результатом исследовательских работ Джаспера Г. Г. стало внедрение интраоперационной регистрации спонтанной электрической активности коры, а также вызванной электрическими стимулами: обнаружил, что электрическая стимуляция может “производить” остаточные заряды, которые являются нежелательным эффектом искусственной стимуляции мозга, но поскольку они, по сути, являются индуцированными электрическими паттернами припадков, он решил, что изучение их может помочь понять, как возникают припадки и как их остановить.2 Уже с середины 1950-х годов электрокортикография стала распространенным методом мониторинга при оперативном лечении эпилепсии.3
Классификация
Обычно электрокортикографию относят к разновидности внутричерепной, или инвазивной электроэнцефалографии. Интракраниальная, или инвазивная электроэнцефалография (англ. intracranial electroencephalography, invasive electroencephalography; иЭЭГ, iEEG) – это способ записи биопотенциалов мозга, требующий предварительного хирургического вмешательства и внутричерепного размещения электродов.4
По способу проведения интракраниальную электроэнцефалографию классифицируют следующим образом:567
- электрокортикография (ЭКоГ) – используются сетки или полосы круглых (пластинчатых) электродов, размещенных субдурально на поверхности обычно одного полушария, не достигая таких глубоких структур, как гиппокамп, миндалевидное тело; электродные сетки обычно содержат множество токосъемных поверхностей, или контактов, что позволяет охватить и одновременно зарегистрировать импульсы, исходящие от значительной площади поверхности коры головного мозга;
- стереотаксическая ЭЭГ (СЭЭГ) – использует цилиндрические глубинные электроды, которые проникают через кожу, череп, все оболочки головного мозга и достигают глубоких корковых и подкорковых структур. Данный метод обеспечивает билатеральный мониторинг поверхностных и глубоких корковых структур, однако только самые поверхностные и глубокие контакты будут находиться в сером веществе, остальные же токосъемные поверхности будут располагаться в белом веществе. Каждый глубинный электрод обычно содержит 6-10 токосъемный поверхностей.
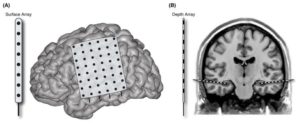
При регистрации электрических потенциалов кортикальных нейронов под костями черепа (субдурально при ЭКоГ, транскортикально/субкортикально при стереотаксической ЭЭГ) повышается чувствительность и исключаются некоторые артефакты, но стоит учитывать, что запись электрической активности ограничивается местоположением электрода, вследствие чего возрастает потенциальная ошибка репрезентативности.8
По времени выполнения записи электрокортикографию подразделяют на:
- интраоперационную – проводится во время выполнения операции, обычно в целях мониторинга эпилептической активности ткани и контроля полной резекции патологического очага; также с целью функционального картирования коры головного мозга9 (параллельно с прямой электростимуляцией) для предупреждения интраоперационного повреждения функционально важных зон коры (зона Брока, поле Вернике, двигательный центр, зоны, отвечающие за сенсорную обработку и т.д.).
- экстраоперационную – запись ведется в течение нескольких часов или суток; проводится вне оперативного лечения пациента; выполняется с целью предоперационной подготовки наряду с МРТ для определения степени поражения и локализации эпилептогенного очага; кроме того, выполняется и после хирургического лечения для определения успешности операции и уверенности в отсутствии эпилептиформной активности.
Электрофизиологические основы
Электрокортикографические сигналы представляют собой синхронизированные постсинаптические потенциалы, которые регистрируются с открытой поверхности коры головного мозга. Генерируются они в пирамидальных кортикальных нейронах, затем проходят через все слои коры головного мозга, спинномозговую жидкость, мягкую, паутинную оболочку до достижения субдурально расположенных электродов. По этой причине пространственное разрешение ЭКоГ намного выше, чем ЭЭГ, что является важнейшим преимуществом при дооперационном планировании.10 ЭКоГ предлагает временное разрешение около 5 мс и пространственное разрешение 1 см.11 Записанный сигнал от электродов по проводам передается на регистрирующий прибор, усилитель, а затем на компьютер, где отображается в виде графика ЭЭГ и отображает импульсы, исходящие не от отдельно взятых нейронов, а от их совокупности. 12
Описание метода
Электрокортикография проводится под общей анестезией, но иногда возможна и местная при необходимости контакта с пациентом.
Для проведения электрокортикографии необходимо специальное оборудование:
- операционный стол, обеспечивающий стабильное положение больного, с автоматизированным механизмом изменения положения;
- трехточечная скоба Mayfield для прочной и надежной фиксации головы;
- хирургический инструментарий: биполяр тупоконечный прямой, набор аспираторов, клипсы с клипсонакладывателем, шприц с раствором новокаина 0,5 % 20 мл / лидокаина 2 % 10 мл + адреналина 0,1 % – 1 мл для гидропрепаровки, скальпель брюшистый, ножницы, набор пинцетов, зажимы, кровоостанавливающие клипсы Michel, кусачки Люэра, пружинный ретрактор, ранорасширитель Янцена;
- набор для краниотомии: коловорот с фрезами, распатор, пила Джигли-Оливекрона с проводником Поленова, ложка Фолькмана, костные кусачки, кусачки Kerrison, скальпель, перфоратор, краниотом, высокоскоростная рукоятка с алмазным бором;
- бритва или машинка для стрижки волос;
- раствор йода спиртовой 5%;
- стерильные ватные тампоны;
- коагулятор хирургический;
- раствор перекиси водорода 3%;
- раствор хлоргексидина 0,05%;
- иглы хирургические;
- иглодержатель Гегара;
- шовный материал (Викрил 3-0, Пролен 4-0).
Ход процедуры
Перед началом проведения данной процедуры необходимо удалить волосы в предполагаемом месте разреза. Точки расположения суперкортикальных электродов определяют на предоперационной МРТ головного мозга. Но стоит понимать, что после краниотомии эти точки будут смещены. Пациента вводят в общий наркоз. Голову пациента фиксируют трёхточечной скобой Mayfield. Операционное поле обрабатывают раствором йода 5%. Далее выполняют краниотомию для обнажения твердой оболочки мозга: сначала проводят “гидропрепаровку” 0,5%-ным раствором новокаина и 0,1%-ым раствором адреналина мягких тканей с целью гемостаза и повышения подвижности кожно-апоневротического лоскута по предполагаемой линии разреза, скальпелем делают продольный разрез кожи необходимой длины с учетом топографии сосудов и нервов, фиксируют края раны зажимом или ранорасширителем, кровотечение останавливают клипсами Michel или кусачками Люэра при кровотечении из эмиссарных вен, распатором освобождают кость от надкостницы, краниотомом формируют костный лоскут из одного фрезевого отверстия, в обнаженную поверхность коры головного мозга имплантируют электродную сетку или полоску. Свободные края раны ушивают трехрядным швом ( 1 ряд- шов на апоневроз, 2 ряд – на подкожную фасцию, 3 ряд непрерывных или узловых / с помощью степлеров – на кожу). Вводится антибиотик, инъекции которого продолжаются на протяжении 7-10 дней после операции.
После того, как внутричерепные электроды имплантируются, пациента переводят из операционной в палату (если это не интраоперационная электрокортикография), подключают проводник к регистрирующему аппарату. Проводник в свою очередь передает получаемые от электродов электрические импульсы на регистрирующий прибор, усилитель, а затем на компьютер, на котором получаемые сигналы отображаются в виде графика ЭЭГ. Пациенты постепенно прекращают прием антиэпилептических препаратов, при необходимости получают обезболивающие. Учитывая наличие проводов, соединяющих электроды с регистрирующим устройством, пациент несколько дней соблюдает строгий постельный режим. В эти дни происходит обнаружение локализации эпилептогенного очага и регистрация интенсивности импульсов, исходящих из него.13
И именно в эти дни мониторинга, в этой клинической обстановке проводятся нейробиологические эксперименты, на которые дает информированное согласие пациент. Информированное согласие основано на понимании пациента, что его участие в исследовании не является обязательным и никак не связано с лечением.14
Электроды
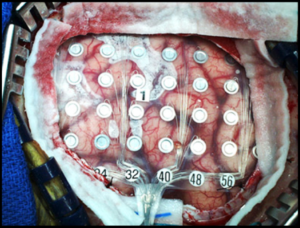
Электроды, используемые при электрокортикографии, стерильны, фиксированы на листе силикона, изготовлены из платины, платино-иридиевого сплава или нержавеющей стали. Чаще используют платиновые электроды, так как они не обладают магнитными свойствами и совместимы с проведением МРТ.15
Макро-ЭКоГ-электроды имеют диаметр токосъемных сайтов от 1 до 15 мм с расстоянием в 10 мм и более между ними.
Микро-ЭКоГ-электроды отличаются контактами диаметром менее 1 мм, интервал между которыми составляет 4 мм и менее.
Электроды соединены тонкими, изолированными друг от друга металлическими проводами, объединенными в кабель, который соединяется с усилителем перед проведением процедуры.
Выпускаются они в виде электродных сеток или пластинок/полосок различных размеров: имеют от 4 до 256 токосъемных поверхностей. Решетки прозрачные, гибкие, все контакты пронумерованы. Их располагают на поверхности коры головного мозга, поэтому изготовлены достаточно гибкими для предупреждения различных повреждений. Например, из-за пульсации артерий ткань мозга смещается, в результате чего может быть повреждена жестким электродом.16
Глубинные электроды обычно изготовлены из платины, имеют цилиндрические токосъемные поверхности, и могут быть имплантированы со стереотаксическим наведением или без него. Они обычно используются при стереотаксической электроэнцефалографии, записывают электрическую активность таких глубоколежащих структур головного мозга, как гиппокамп, миндалевидное тело.
Электроды прямого электрического стимулирования подобны глубинным электродам: с линейными зондами и цилиндрическими контактами. Но при этом они меньшего диаметра, а также имеют меньше контактных сайтов, но расположены они ближе друг к другу.17
Сравнение с аналогичными методами
Примерами аналогичных электрокортикографии методов по функциональному анализу головного мозга являются электроэнцефалография (ЭЭГ), магнитоэнцефалография, функциональная магнитно-резонансная томография.
Главным их отличием от ЭКоГ является отсутствие инвазивности (то есть, не проводится краниотомия, сигналы регистрируются с поверхности кожи головы), а как следствие гораздо более меньшая чувствительность и точность показаний, так как 75% электрических импульсов искажается проходя через кости черепа, кожу. Кроме того, следует отметить и другие отличия электрокортикографии:18
- гибкое размещение регистрирующих и стимулирующих электродов;
- может быть выполнена на любом этапе: до, во время и после операции;
- позволяет проводить прямую электростимуляцию головного мозга, выявляя критические участки коры, которых следует избегать во время операции;
- высокое временное и пространственное разрешение;
- отношение сигнал / шум лучше из-за более близкого расположения к нейронной активности.
Клинические показания и перспективы применения
Клинические показания
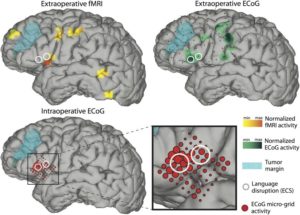
В настоящее время очень часто диагностируется резистентная эпилепсия, приступы которой не купируются антиконвульсантами. В таком случае больным показано хирургическое вмешательство. Прежде чем приступить к операции по удалению эпилептического очага в головном мозге, необходимо сделать диагностическую электрокортикографию и МРТ для определения степени поражения и локализации очага. Во время проведения хирургического вмешательства тоже необходимо проводить электрокортикографию (интраоперационная ЭКоГ) для мониторинга эпилептической активности ткани и полной резекции патологического очага. После операции также необходимо выполнить электрокортикографию для определения успеха операции и убедиться в отсутствии эпилептиформной активности.
Также, в процессе электрокортикографии может быть выполнена прямая электростимуляция мозга для терапевтического лечения болезни Паркинсона, эссенциального тремора.19
Кроме того, диагностическая электрокортикография необходима для выявления локализации функционально важных зон коры головного мозга (например, зоны, отвечающей за речь, моторику, сенсорную обработку и др.) с целью предупреждения повреждения их во время операции по удалению эпилептогенного очага или, например, опухоли. Такая процедура называется функциональным картированием коры головного мозга в реальном времени. Выполняется она под местной анестезией для возможности взаимодействия и контакта с пациентом. При ее выполнении прибегают к использованию глубинных электродов с целью зондирования отдельных зон коры головного мозга для определения их индивидуальной функциональности.20
Перспективы применения
Уже в XX веке стало использоваться такое понятие, как “нейрокомпьютерный интерфейс”. Разработки этого направления в области медицины планируют использовать при параличах и других неврологических заболеваниях.21 Интерфейсы “мозг-компьютер” (англ. brain computer interfaces; ИМК, BCI) – это прямые нейронные интерфейсы, которые обеспечивают управление протезными, электронными или коммуникационными устройствами посредством сигналами мозга человека.
Электрокортикографические интерфейсы мозг-компьютер (англ. Electrocorticographic brain computer interfaces; ЭКоГ-ИМК, ECoG-BCIs) представляют огромные возможности восстановления необходимых утерянных функций у людей, страдающих от различных неврологических нарушений. Большая работа в этой области на сегодняшний день сосредоточена на использовании ЭКоГ-сигналов, записанных с поверхности коры головного мозга, в качестве управляющих сигналов для внешних устройств.22
В основе некоторых разработок ИМК лежит декодирование сигналов мозга, характеризующих кинетические параметры движений человека (например, скорость движения руки или сгибание пальцев), затем эти сигналы используют при параличах, чтобы пациент имел возможность управлять устройством вывода, то есть имел возможность двигать рукой, пальцами или протезом.23 Кроме того, с помощью ЭКоГ планируют декодировать воображаемую речь или музыку, и пользователи (или немые пациенты) представляли бы себе слова, предложения или музыку, которые нейрокомпьютерный интерфейс может непосредственно интерпретировать.242526
Не менее важным, но менее изученным применением электрокортикографических интерфейсов мозга является направление входного сигнала в кору головного мозга с помощью электродов ЭКоГ для прямой электрической стимуляции. Совмещение прямой электрической стимуляции с записью ЭКоГ представляет собой двунаправленный компьютерный интерфейс головного мозга.
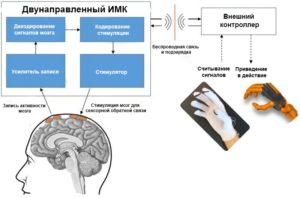
Кроме того, исследуется возможность лечения психических заболеваний (посттравматическое стрессовое расстройство, депрессия, обсессивно-компульсивное расстройство, синдром Туретта и др.) посредством прямого электрического стимулирования головного мозга.27
Научное-исследовательское применение
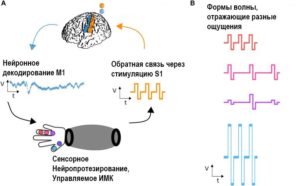
В настоящее время в процессе проведения электрокортикографии распространено выполнение прямой электростимуляции головного мозга с целью поиска возможностей восстановления нормальных функций соматосенсорной системы после различных её повреждений и индукции кортикальной пластичности для реабилитации при инсульте. Также выше упоминалось научно-исследовательское применение ЭКоГ с целью декодирования сигналов головного мозга для дальнейшего их использования при наличии у больного протезов или параличей, чтобы пациент имел возможность совершать все необходимые движения парализованными частями тела или протезом. Кроме того, было упомянуто о том, что с помощью ЭКоГ планируют декодировать воображаемую речь или музыку, и пользователи (или немые пациенты) представляли бы себе слова, предложения или музыку, которые нейрокомпьютерный интерфейс может непосредственно интерпретировать. Также метод электрокортикографии уже используют в области оптогенетики, но пока лишь экспериментально, на грызунах.28
Прямая электрическая стимуляция головного мозга в зависимости от своей топографической локализации может либо индуцировать, либо подавлять нейрональную активность. Например, электростимуляция зоны Брока может приводить к нарушениям речи, в то время как стимуляция соматосенсорной коры и двигательного центра приводит к их активации. Считается, что от кортикальной геометрии, ориентации нервных волокон, являются импульсы анодными или катодными зависит то, какие нейроны будут активированы. Доказано, что нейроны, расположенные глубже в коре головного мозга, активируются в большей степени во время катодной субдуральной стимуляции, в то время как поверхностно расположенные нейроны активируются во время анодной стимуляции. Так, влияние анизотропии на нейрональное возбуждение от электростимуляции иллюстрирует важность детальной, точной топографической анатомии для понимания и прогнозирования её эффектов.29
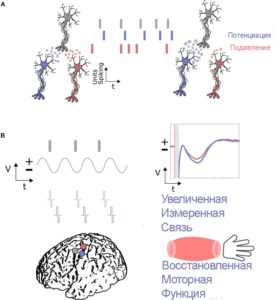
Еще одно применение прямой электростимуляции головного мозга, которое в настоящее время изучается, – это индукция кортикальной пластичности. Это понятие подразумевает под собой активацию или другое изменение взаимодействия между нейронами различных областей коры головного мозга, что может помочь пациентам в процессе реабилитации после перенесенного инсульта. Ведь инсульт является причиной инвалидности: 15-30% выживших остаются инвалидами навсегда. В данной области исследований очень обсуждаема идея пластичности Гебба (1949 г.). Основные принципы нейронной пластичности включают в себя время активности между нейронами, приводящее к усилению связей, где потенцирование происходит, если нейроны запускаются в подходящее, причинно, и депрессия возникает, если нейроны не запускаются в соответствующее время (A). Эти принципы могут быть использованы для нейромодуляции с помощью прямой электростимуляции и ECoG-BCI путем стимуляции вблизи определенной поврежденной кортикальной области (фиолетового цвета), основанной на активности в защищенной кортикальной области (серого цвета). Эта активность может быть маркером возбуждения нейронов или потенциалом локального поля, возникающим, когда нейроны с большей вероятностью запускаются синхронно. Тогда стимуляция в определенный момент может привести к увеличению связности, измеряемой с помощью маркеров, таких как вызванные потенциалы, и восстановленной моторной функции относительно нулевоц линии. Поврежденная область, не подвергшаяся нейромодуляции, показана красным, где вызванные потенциалы не имеют положительной модуляции и моторная функция не восстанавливается (B).
Кроме того, развивающаяся область оптогенетики описывает использование электрокортикографии, генетической модификации и оптических методов для активации или инактивации специфических нейронов in vivo с целью восстановления зрения слепым людям. Было показано, что оптогенетика изменяет функциональную связность в сенсомоторной коре головного мозга у приматов. Но для человечества эти исследования могут затянуться, так как зависят от генетической модификации нейронов.30
Footnotes
- Александров М.В. История электроэнцефалографии: русская увертюра мировой симфонии (к столетию работ В. В. Правдич-Неминского) [Электроный ресурс] / М.В. Александров // Биомедицинский журнал. – 2012. – Т. 13. – Режим доступа: http://www.medline.ru/public/pdf/13_030.pdf
- Anthony Ritaccio, Peter Brunner, Aysegul Gunduz, Dora Hermes, Lawrence J. Hirsch, Joshua Jacobs, Kyousuke Kamada, Sabine Kastner, Robert T. Knight, Ronald P. Lesser, Kai Miller, Terrence Sejnowski, Gregory Worrell, and Gerwin Schalk. Proceedings of the fifth International Workshop on Advances in electrocorticography. Epilepsy Behav. 2014 Dec; 0: 183–192. ePub.26 Oct 2014. DOI: 10.1016/j.yebeh.2014.09.015.
- Александров М.В., Улитин А.Ю. Интраоперационная электрокортикография: возможности и перспективы // Вестник Российской Военно-медицинской академии. – 2012. – №4 (40). – С. 245.
- Aashit K. Shah and Sandeep Mittal. Invasive electroencephalography monitoring: Indications and presurgical planning. Annals of Indian Academy Neurology 2014 Mar; 17(Suppl 1): S89–S94.DOI: 10.4103/0972-2327.128668
- Kieran C. R. Fox, Brett L. Foster, Aaron Kucyi, Amy L. Daitch and Josef Parvizi. Intracranial electrophysiology of the human default network. – Trends Cogn Sci. – April 2018; 22(4): 307–324. ePub: 7 Mar 2018. DOI: 10.1016/j.tics.2018.02.002
- Yinghua Wang, Jiaqing Yan, Jianbin Wen, Tao Yu, Xiaoli Li. An Intracranial Electroencephalography (iEEG) Brain Function Mapping Tool with an Application to Epilepsy Surgery Evaluation. Frontiers in neuroinformatics. 2016; 10: 15. ePub. 25 Apr 2016. DOI: 10.3389/fninf.2016.00015
- Aashit K. Shah and Sandeep Mittal. Invasive electroencephalography monitoring: Indications and presurgical planning. Annals of Indian Academy Neurology 2014 Mar; 17(Suppl 1): S89–S94.DOI: 10.4103/0972-2327.128668
- Aashit K. Shah and Sandeep Mittal. Invasive electroencephalography monitoring: Indications and presurgical planning. Annals of Indian Academy Neurology 2014 Mar; 17(Suppl 1): S89–S94.DOI: 10.4103/0972-2327.128668
- AmiLyn M Taplin, Adriana de Pesters, Peter Brunner, Dora Hermes, John C Dalfino, Matthew A Adamo, Anthony L Ritaccio, Gerwin Schalk. Intraoperative Mapping of Expressive Language Cortex Using Passive Real-Time Electrocorticography. Epilepsy & Behavior Case Reports.16 Mar 2016;5:46-51. DOI: 10.1016/j.ebcr.2016.03.003
- Hashiguchi, K; Morioka, T; Yoshida, F; Miyagi, Y; et al. (2007). “Correlation between scalp-recorded electroencephalographic and electrocorticographic activities during ictal period”. Seizure. 16 (3): 238 247. doi:10.1016/j.seizure.2006.12.010. PMID 17236792.
- Asano, E; Juhasz, C; Shah, A; Muzik, O; et al. (2005). “Origin and propagation of epileptic spasms delineated on electrocorticography”. Epilepsia. 46 (7): 1086–1097. doi:10.1111/j.1528-1167.2005.05205.x. PMC 1360692. PMID 16026561.
- Kieran C. R. Fox, Brett L. Foster, Aaron Kucyi, Amy L. Daitch and Josef Parvizi. Intracranial electrophysiology of the human default network. – Trends Cogn Sci. – April 2018; 22(4): 307–324. ePub: 7 Mar 2018. DOI: 10.1016/j.tics.2018.02.002
- Kieran C. R. Fox, Brett L. Foster, Aaron Kucyi, Amy L. Daitch and Josef Parvizi. Intracranial electrophysiology of the human default network. – Trends Cogn Sci. – April 2018; 22(4): 307–324. ePub: 7 Mar 2018. DOI: 10.1016/j.tics.2018.02.002
- Jeremy Hill, Disha Gupta, Peter Brunner , Aysegul Gunduz, Matthew A. Adamo, Anthony Ritaccio, and Gerwin Schalk. Recording Human Electrocorticographic (ECoG) Signals for Neuroscientific Research and Real-time Functional Cortical Mapping. Journal of visualized experiments. 2012; (64): 3993. ePub.26 Jun 2012. DOI: 10.3791/3993
- Aashit K. Shah and Sandeep Mittal. Invasive electroencephalography monitoring: Indications and presurgical planning. Annals of Indian Academy Neurology 2014 Mar; 17(Suppl 1): S89–S94.DOI: 10.4103/0972 2327.128668
- Schuh, L., & Drury, I. (1997). Intraoperative electrocorticography and direct cortical electrical stimulation. Seminars in Anesthesia, Perioperative Medicine and Pain, 16(1), 46–55. DOI:10.1016/s0277-0326(97)80007-4
- David J Caldwell, Jeffrey G Ojemann, Rajesh P N Rao. Direct Electrical Stimulation in Electrocorticographic Brain-Computer Interfaces: Enabling Technologies for Input to Cortex. Front Neurosci. 2019; 13: 804. ePub,7 Aug 2019. DOI: 10.3389/fnins.2019.00804
- N Jeremy Hill, Disha Gupta, Peter Brunner, Aysegul Gunduz, Matthew A Adamo, Anthony Ritaccio, Gerwin Schalk. Recording Human Electrocorticographic (ECoG) Signals for Neuroscientific Research and Real-Time Functional Cortical Mapping. Journal of visualized experiments. 2012; (64): 3993. ePub. 26 Jun 2012. DOI: 10.3791 / 3993
- David J Caldwell, Jeffrey G Ojemann, Rajesh P N Rao. Direct Electrical Stimulation in Electrocorticographic Brain-Computer Interfaces: Enabling Technologies for Input to Cortex.Front Neurosci. 2019; 13: 804. ePub,7 Aug 2019. DOI: 10.3389/fnins.2019.00804
- AmiLyn M Taplin, Adriana de Pesters, Peter Brunner, Dora Hermes, John C Dalfino, Matthew A Adamo, Anthony L Ritaccio, Gerwin Schalk. Intraoperative Mapping of Expressive Language Cortex Using Passive Real-Time Electrocorticography. Epilepsy & Behavior Case Reports.16 Mar 2016;5:46-51. DOI: 10.1016/j.ebcr.2016.03.003
- David J Caldwell, Jeffrey G Ojemann, Rajesh P N Rao. Direct Electrical Stimulation in Electrocorticographic Brain-Computer Interfaces: Enabling Technologies for Input to Cortex. Front Neurosci. 2019; 13: 804. ePub,7 Aug 2019. DOI: 10.3389/fnins.2019.00804
- David J Caldwell, Jeffrey G Ojemann , Rajesh P N Rao. Direct Electrical Stimulation in Electrocorticographic Brain-Computer Interfaces: Enabling Technologies for Input to Cortex. Front Neurosci. 2019; 13: 804. ePub,7 Aug 2019. DOI: 10.3389/fnins.2019.00804
- Wang, Q. Ji, K. J. Miller and Gerwin Schalk. Prior knowledge improves decoding of finger flexion from electrocorticographic signals., ORIGINAL RESEARCH ARTICLE Frontiers Neuroscience. 28 Nov 2011. DOI:10.3389 / fnins.2011.00127.
- Allison, Brendan Z. (2009). “Chapter 2: Toward Ubiquitous BCIs.”. Brain-Computer Interfaces. Springer. pp. 357–387. ISBN 978-3-642-02091-9.
- Swift, James; Coon, William; Guger, Christoph; Brunner, Peter; Bunch, M; Lynch, T; Frawley, T; Ritaccio, Anthony; Schalk, Gerwin (2018). “Passive functional mapping of receptive language areas using electrocorticographic signals”. Clinical Neurophysiology. 6 (12): 2517–2524. doi:10.1016/j.clinph.2018.09.007. PMC 6414063. PMID 30342252
- Martin, Stephanie; Iturrate, Iñaki; Millán, José del R.; Knight, Robert; Pasley, Brian N. (2018). “Decoding Inner Speech Using Electrocorticography: Progress and Challenges Toward a Speech Prosthesis”. Frontiers in Neuroscience. 12: 422. doi:10.3389/fnins.2018.00422. PMC 6021529. PMID 29977189
- David J Caldwell, Jeffrey G Ojemann, Rajesh P N Rao. Direct Electrical Stimulation in Electrocorticographic Brain-Computer Interfaces: Enabling Technologies for Input to Cortex. Front Neurosci. 2019; 13: 804. ePub,7 Aug 2019. DOI: 10.3389/fnins.2019.00804
- David J Caldwell, Jeffrey G Ojemann, Rajesh P N Rao. Direct Electrical Stimulation in Electrocorticographic Brain-Computer Interfaces: Enabling Technologies for Input to Cortex. Front Neurosci. 2019; 13: 804. ePub,7 Aug 2019. DOI: 10.3389/fnins.2019.00804
- David J Caldwell, Jeffrey G Ojemann, Rajesh P N Rao. Direct Electrical Stimulation in Electrocorticographic Brain-Computer Interfaces: Enabling Technologies for Input to Cortex. Front Neurosci. 2019; 13: 804. ePub,7 Aug 2019. DOI: 10.3389/fnins.2019.00804
- David J Caldwell, Jeffrey G Ojemann, Rajesh P N Rao. Direct Electrical Stimulation in Electrocorticographic Brain-Computer Interfaces: Enabling Technologies for Inpu to Cortex. Front Neurosci. 2019; 13: 804. ePub,7 Aug 2019. DOI: 10.3389/fnins.2019.00804