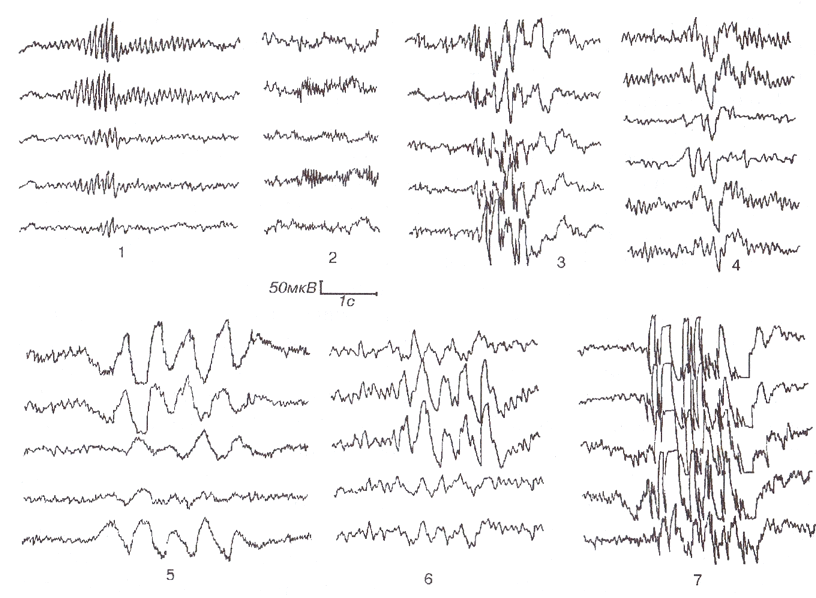
1 — α-волн высокой амплитуды; 2 — β-волн высокой амплитуды; 3 — острых волн; 4 — полифазных колебаний; 5 — δ-волн; б — θ-волн; 7 — комплексов спайк-волна.Типы активности 1, 2, 4-6 являются вспышками, но не разрядами. Вспышки активности 3 и 7 являются разрядами и относятся к эпилептиформной активности.
Разряд (Discharge) — интерпретативный термин, обычно используемый для обозначения таких пароксизмальных паттернов, как эпилептиформные паттерны и паттерны эпилептического припадка. Так, на рис.1 типы активности 1, 2, 4-6 являются вспышками, но не разрядами. Вспышки активности 3 и 7 являются разрядами и относятся к эпилептиформной активности. Синонимом (не вполне удачным) термина «разряд» является пароксизм.
Биохимические механизмы, лежащие в основе формирования эпилептических разрядов
В основе формирования эпилептических разрядов, часто лежит патологическое воздействие, нарушающее баланс между процессами возбуждения и торможения в нервной ткани. В обычных условиях процессы возбуждения нейронов осуществляются посредством изменения концентраций ионов калия (К+) и натрия (Na+) во вне и внутриклеточной средах. В этом процессе принимают участие т.н. быстрые каналы мембраны, обеспечивающие быстрый переход ионов К+ и Na+ через мембрану нервной клетки. Такое изменение концентраций ионов изменяет поляризацию мембраны на ограниченном участке, формируя т.н. потенциал действия (ПД). Эти процессы преимущественно происходят в дендритах и аксоне нейрона. Количество ионов, формирующих пик одного ПД, очень мало, например, расход внутриаксонального К+, при этом приблизительно равен одной миллионной доле внутреннего калиевого запаса и энергии мембранных градиентов может хватить на 5—105 ПД без подзарядки. Восстановление ионных градиентов для повторных циклов формирования ПД обеспечивает работа натрий—калиевого насоса мембраны, представляющего энергозависимый процесс, протекающий с расходом молекул энергетического субстрата — АТФ.
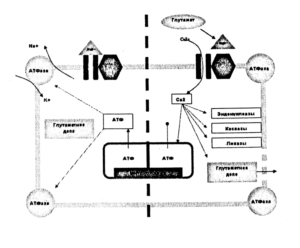
При развитии патологического процесса, связанного с длительной активацией нейронных структур (например эпилепсия), постоянное и продолженное воздействие вызывает приводит к быстрому истощению внутриклеточных энергетических депо. В этих условиях экономичный механизм формирования аксонального ПД исчезает, поскольку с утратой запасов молекул АТФ перестает работать механизм ионного насоса. При отсутствии внешнего воздействия этот механизм прерывает формирование ПД и дает клетке возможность восстановиться, но в случае эпилепсии продолжающееся воздействие вынуждает искать новые пути поддержания ПД, и в процесс формирования ПД включаются ионные каналы сомы нейрона, обладающие возможностью пропускать ионы Са2+. Ток ионов Са2+ через кальциевые каналы сомы осуществляющийся по электрохимическому градиенту, развивается медленнее натриевого, и гораздо медленнее инактивируется. Такой механизм способен поддерживать длительный ПД нервной клетки с меньшим расходом энергетических депо.
Но длительное сохранение повышенной концентрации ионов Са2+ во внутриклеточном пространстве, приводит к активации многочисленных химических процессов, связываясь в комплекс с кальмодулином и активируя его, Са2+ начинает контролировать активность различных внутриклеточных ферментов, таких как синтаз оксида азота, каспаз, липаз, эндонуклеаз, и др. В результате, запускается процесс программируемой гибели клетки – апоптоз в ходе которого высвобождается большое количество медиатора – глутамата. В литературе, этот механизм чаще всего носит название глутамат-кальциевой эксайтотоксичности и рассматривается как основной механизм возбуждения нервной клетки в патологических условиях.
Следующим участником формирования и поддержания патологического процесса становится глутамат – аминокислота широко представленная в нервной системе и выполняющая множество функций, в частности, как возбуждающий медиатор, участвующий в распространении эпилептического разряда. В нейронной мембране, чувствительность к глутамату имеют несколько групп т.н. NMDA рецепторов, воздействие на которые производит активацию и открытие кальциевых каналов. В этом механизме активное участие помимо ионов кальция принимают ионы магния (Mg2+), представляющие собой инактивирующее рецептор вещество.
Среди ионотропных рецепторов глутамата выделены несколько семейств по различиям в фармакологических свойствах и структуре. Наибольший интерес исследователей вызывают: АМРА, NMDA и КА – подтипы. АМРА-рецепторы обладают меньшим сродством к глутамату, чем NMDA-рецепторы, но они обладают быстрой кинетикой и формируют быстрый компонент возбуждающего постсинаптического потенциала. Отличительной особенностью NMDA-рецепторов является то, что они блокируются ионами магния по потенциал-зависимому механизму. Этот механизм работает и в физиологических условиях, но ослабляется при снижении величины потенциала покоя. Другая специфическая черта NMDA-рецепторов заключается в том, что для активации им требуется глицин в качестве коагониста глутамату. KA-рецепторы сходны по своей структуре с АМРА-рецепторами, но в отличие от них имеют сродство к каиновой кислоте. В настоящее время, считается, что KA-рецепторы в большей степени ответственны за процессы развития клеточной гибели, чем АМРА и NMDA.
Таким образом, активация нейрона со стороны первичного очага возбуждения в условиях повышенной концентрации ионов Са2+ и пониженной концентрации ионов Mg2+ приводит не только к активации нервной системы, но и поддержании длительного возбуждения, посредством активации глутаматэргического механизма (рис. 2).
При непосредственном повреждении нервной ткани, затрагивающие тела нейронов, происходит выброс большого количества биологически активных веществ, вызывающих изменение буферных свойств ткани. В дальнейшем происходит продолженное раздражение нервных клеток, что приводит к истощению K+/Na+ механизма формирования ПД и включению в процесс поддержания возбуждения ионов Са2+. В свою очередь, поступивший во внутриклеточное пространство кальций активирует процессы апоптоза и запускает механизм глутаматной эксайтотоксичности, вызывающий лавинообразную активацию АМРА и NMDA рецепторов, которые еще открывают еще больше кальциевых каналов, формируя патологический патогенетический круг. В результате обеспечивается общее изменение свойств пораженного участка нервной ткани, что и проявляется формированием очага стойкого возбуждения.