Нейрофизиологический интраоперационный мониторинг (НИОМ) все чаще используется для уменьшения неврологических осложнений после оперативных вмешательств, при которых нервная система подвергается риску. Нейрофизиологический интраоперационный мониторинг позволяет оценить неврологические функции, когда невозможно провести объективный осмотр пациента. Часто нейрофизиологи способны предупредить хирурга об угрозе повреждения и неврологических осложнений. Таким образом, хирург может принять решение о прекращении операции или изменении хирургической тактики. С целью мониторинга сохранности функций нервной системы применяется несколько методов, в зависимости от типа операции и тех компонентов нервной системы, которые подвергаются риску в процессе вмешательства. К часто применяемым методам в рамках нейрофизиологического интраоперационного мониторинга относятся регистрация акустических стволовых вызванных потенциалов (АСВП), соматосенсорных вызванных потенциалов (ССВП), транскраниальная магнитная стимуляция (ТМС) — магнитное раздражение моторной зоны коры, электромиография (ЭМГ) и электроэнцефалография (ЭЭГ). Часто в клинической практике применяется комбинация методов с целью комплексного мониторинга.
Для лучшего понимания каждый из указанных методов описывается отдельно.
- Акустические стволовые вызванные потенциалы (АСВП)
- Соматосенсорные вызванные потенциалы (ССВП)
- Моторные вызванные потенциалы
ЭЛЕКТРОМИОГРАФИЯ
Когда существует угроза повреждения нервных корешков во время оперативных вмешательств, мониторинг спонтанной и стимуляционной ЭМГ позволяет получить полезную информацию для предотвращения риска. Этот вид нейрофизиологического интраоперационного мониторинга позволяет выявить различные аномалии и снизить частоту неврологических осложнений.
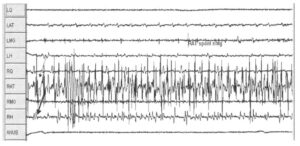
выявляет нейротонический разряд, преимущественно исходящий из правой передней большеберцовой мышцы (корешки I.4-L5). во время хирургического лечения синдрома фиксированного спинного мозга. Показана запись во время одной секунды
Мониторинг функции периферической нервной системы может проводиться с помощью спонтанной ЭМГ, стимуляционной электромиографии (ЭМГ) или регистрации потенциалов действия нерва. Для регистрации спонтанной (или стимуляционной) ЭМГ в мышцу, иннервируемую нервом, который подвергается риску поражения, вводят игольчатые или проволочные электроды. Выраженное повреждение нерва во время диссекции (рассечения) вызывает высокочастотные разряды, называемые нейротоническими разрядами. Короткие вспышки нейротонических разрядов указывают на транзиторное (переходящее повреждение нерва); стойкие разряды указывают на возможность необратимого поражения. На Рис. 1 показана регистрация сигнала ЭМГ с левой четырехглавой мышцы бедра (латеральное брюшко), левой передней большеберцовой мышцы, медиальной головки левой икроножной мышцы, левой полусухожильной мышцы, с тех же мышц на правой стороне (четырехглавая мышца бедра (латеральное брюшко), передняя большеберцовая мышца, медиальная головка икроножной мышцы, полусухожильная мышца справа), а также с мышц анального сфинктера, при помощи игольчатых электродов. Регистрируется пробег высокочастотных разрядов, соответствующих нейротоническим разрядам с началом с правой передней большеберцовой мышцы (тонкая стрелка) и менее выраженный разряд регистрируется с правой икроножной мышцы (толстая стрелка). Услышав разряд, хирург прекращает диссекцию, проводит орошение операционного поля, и нейротонический разряд исчезает.
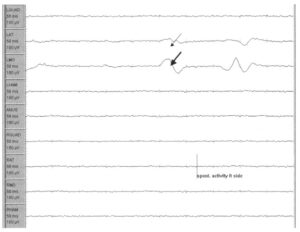
демонстрирует периодически возникающую спонтанную мышечную активность из левой передней большеберцовой мышцы и медиальной головки икроножной мышцы слева. Проводится мониторинг ЭМГ следующих мышц: левой четырехглавой мышцы бедра (латеральное брюшко), левой передней большеберцовой мышцы, медиальной головки левой икроножной мышцы, левой полусухожильной мышцы, с тех же мыши на правой стороне (четырехглавая мышца бедра (латеральное брюшко), передняя большеберцовая мышца, медиальная головка икроножной мышцы, полусухожильная мышца справа), а также с мышц анального сфинктера
Минимальное раздражение нерва часто вызывает спонтанный разряд двигательных единиц, иннервируемых этим нервом, который проявляется низкочастотными короткими разрядами в процессе мониторинга спонтанной ЭМГ. Эти разряды не ассоциированы с послеоперационными осложнениями. На Рис. 2 представлена запись на скорости 50 мм/с, полученная у пациента в процессе хирургического лечения синдрома фиксированного спинного мозга. Во время ирригации (орошения) хирургического поля низкочастотные разряды регистрируются в левой передней большеберцовой мышце (тонкая стрелка) и медиальной головке икроножной мышцы (тонкая стрелка), а впоследствии исчезают через несколько секунд.
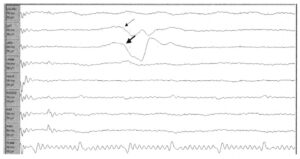
демонстрирует ответы левой передней большеберцовой мышцы и медиальной головки икроножной мышцы. Представлена запись с разверсткой 100 мс. В монтаж включены следующие мышцы: левая четырехглавая мышца бедра (латеральное брюшко), левая передняя большеберцовая мышца, медиальная головка левой икроножной мышцы, левая полусухожильная мышца, те же мышцы на правой стороне (четырехглавая мышца бедра (латеральное брюшко), передняя большеберцовая мышца, медиальная головка икроножной мышцы, полусухожильная мышца справа), а также мышцы анального сфинктера
Стимулированная ЭМГ может применяться для идентификации структур нервной системы в процессе хирургического вмешательства. Например, если опухоль окружена нервной тканью, локальная стимуляция различных областей вокруг опухоли может помочь в определении вовлеченных компонентов нервной системы. Или, если анатомическое строение не достаточно ясно, что бывает часто, возможна стимуляция структур в области хирургического поля, и в соответствии с полученными у пациента ответами эти структуры могут быть правильно идентифицированы. На Рис. 3 стимуляция нервного корешка вызывает запускаемый стимуляцией ответ левой передней большеберцовой мышцы (тонкая стрелка) и медиальной головки икроножной мышцы (толстая стрелка). Таким образом, стимулируемый нервный корешок, вероятнее всего, является нервным корешком L5.
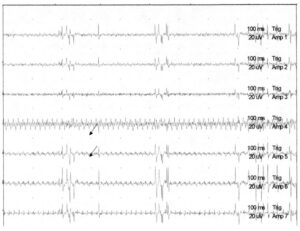
демонстрирует артефакт, напоминающий нейротонический разряд. На рисунке показана одна секунда записи. В монтаж включены следующие мышцы: левая четырехглавая мышца бедра (латеральное брюшко), левая передняя большеберцовая мышца, медиальная головка левой икроножной мышцы, левая полусухожильная мышца, те же мышцы на правой стороне (передняя большеберцовая мышца, медиальная головка икроножной мышцы, полусухожильная мышца справа), а также мышцы анального сфинктера
Как и при других видах мониторинга, артефакты встречаются и при мониторинге ЭМГ.
Отличить артефакты от миотонических разрядов крайне важно, чтобы избежать ненужных хирургических манипуляций. На Рис. 4 пациент проходит хирургическое лечение по поводу синдрома фиксированного спинного мозга. Хотя наблюдаются пробеги высокочастотных разрядов, они не являются нейротоническими разрядами. Они широко распространенные, ритмичные и имеют сходную морфологию по всем каналам (стрелки), что позволяет диагностировать артефакт.
ЭЛЕКТРОЭНЦЕФАЛОГРАФИЯ
На ЭЭГ могут выявляться изменения, связанные с церебральным кровотоком. Поэтому ЭЭГ часто применяется в качестве важного диагностического инструмента в процессе хирургических вмешательств, которые могут вызывать нарушения кровотока в головном мозге. Также ЭЭГ может применяться непосредственно для регистрации эпилептиформной, неэпилептиформной активности или вызванных потенциалов во время хирургических процедур, которые требуют убедительного подтверждения сохранности корковых функций.
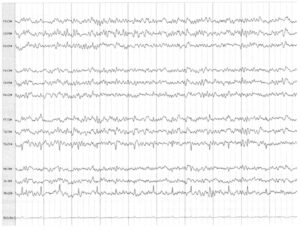
во время операции каротидной эндартерэктомии демонстрирует симметричную церебральную активность с двух сторон после клипирования правой каротидной артерии. Применяется продольный биполярный монтаж (левый электрод — над правым; парасагиттальный -над темпоральным (височным)). Электроды Fpl и Fp2 не применяются, так как в эти зоны помещены датчики для мониторинга анестезии
ЭЭГ-мониторинг часто применяется в ситуациях, при которых возможно прерывание кровотока в головном мозге. Каротидная эндартерэктомия — частое показание для проведения ЭЭГ-мониторинга. Если во время каротидной эндартерэктомии отмечено замедление ЭЭГ на ипсилатеральной стороне по отношению к клипированной артерии, решается вопрос о проведении обходного шунтирования. Если замедление или снижение амплитуды ЭЭГ зарегистрировано в ипсилатеральном полушарии, обычно оно возникает в течение минуты после клипирования. Отсутствие нарушений на ЭЭГ позволяет предполагать адекватный коллатеральный кровоток. На Рис. 5 представлена запись продолжительностью 10 с, зарегистрированная через несколько минут после клипирования сонной артерии. Запись ЭЭГ выглядит симметричной с двух сторон, что позволяет предполагать адекватный коллатеральный кровоток.
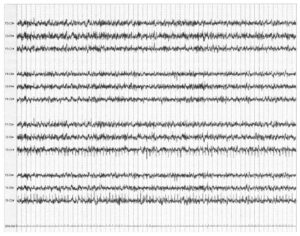
того же пациента (см. Рис. 5). Представлена запись на скорости разверстки 60 мм/с. Обращает на себя внимание симметричная биоэлектрическая активность с двух сторон
При проведении мониторинга ЭЭГ во время каротидной эндартерэктомии часто применяют более медленную запись (60 мм/с), что позволяет акцентировать асимметричное замедление и/или исчезновение быстрых частот.
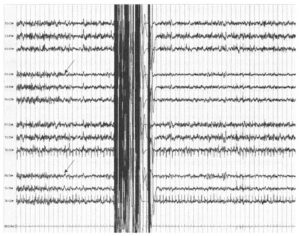
демонстрирует утрату быстрых частот в правом полушарии после клипирования правой каротидной артерии
Как отмечено ранее, более медленная запись ЭЭГ (скорость разверстки) может помочь для идентификации замедления биоэлектрической активности ЭЭГ или исчезновения быстрых частот. Если замедление активности возникает во время клипирования каротидной артерии, решается вопрос о создании шунта для восстановления коллатерального кровотока и компенсации ятрогенной ишемии. На Рис. 7 показана запись во время каротидной эндартерэктомии справа; приблизительно через 1 минуту после клипирования в правой каротидной артерии отмечено исчезновение быстрых частот в ипсилатеральном полушарии (стрелки). При удалении клипсы ЭЭГ возвращается к исходному уровню и дефицит после хирургического вмешательства отсутствует.
СПИСОК ДОПОЛНИТЕЛЬНОЙ ЛИТЕРАТУРЫ
- James M.L., Husain A.M. Brainstem auditory evoked potential monitoring: when is change in wave V significant? Neurology. 2005; 65 (10): 1551 — 1555.
- Legatt A.D. Mechanisms of intraoperative brainstem auditory evoked potential changes. J. Clin. Neurophysiol. 2002; 19 (5): 396-408.
- MacDonald D. B. Safety of intraoperative transcranial electrical stimulation motor evoked potential monitoring. J. Clin. Neurophysiol. 2002; 19 (5): 416—429.
- Nuwer M.R., Dawson E.G., Carlson L.G., et al. Somatosensory evoked potential spinal cord monitoring reduces neurologic deficits after scoliosis surgery: results of a large multicenter survey. Electroencephalogr. Clin. Neurophysiol. 1995; 96 (1): 6—11.
- Radtke R.A., Erwin C. Bf, Wilkins R.H. Intraoperative brainstem auditory evoked potentials: significant decrease in postoperative morbidity. Neurology. 1989; 39 (2Pt 1): 187-191.
- Robertson S.C., Traynelis КС., Yamada T.T. Identification of the sensorimotor cortex with SSEP phase reversal. In: Loftus C.M., Traynelis V.C., eds. Intraoperative Monitoring Techniques in Neurosurgery. McGraw-Hill, New York, 1994: 107-111.
- Seyal M., Mull B. Mechanisms of signal change during intraoperative somatosensory evoked potential monitoring of the spinal cord. J. Clin. Neurophysiol. 2002; 19 (5): 409-415.