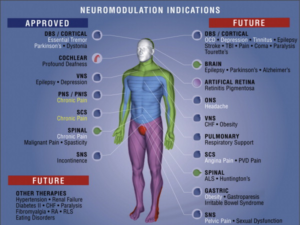
Нейромодуляция – это изменение нервной активности посредством направленной доставки стимула, такого как электрическая стимуляция или химические вещества, в определенные участки тела. Она используется для нормализации или усиления функции нервной ткани. Нейромодуляция – это развивающаяся терапия, которая может включать ряд электромагнитных стимулов, таких как магнитное поле, электрический ток или лекарство, вводимое непосредственно в субдуральное пространство (интратекальная доставка лекарств). Новые методики включают целевое введение генов или генных регуляторов и света (оптогенетика), и к 2014 году это было продемонстрировано на моделях млекопитающих и были получены первые данные на людях.1
Как работает нейромодуляция
Нейромодуляция работает либо путем активной стимуляции нервов для получения естественной биологической реакции, либо путем применения целевых фармацевтических агентов в крошечных дозах непосредственно к месту действия.
Устройства нейростимуляции включают приложение электродов к головному, спинному мозгу или периферическим нервам. Эти точно размещенные электроды через удлинитель подключаются к генератору импульсов и источнику питания, который генерирует необходимую электрическую стимуляцию. Электрический ток низкого напряжения проходит от генератора к нерву и может либо подавлять болевые сигналы, либо стимулировать нервные импульсы там, где они раньше отсутствовали.
В случае фармакологических агентов, доставляемых с помощью имплантированных насосов, лекарство можно вводить в меньших дозах, поскольку оно не должно метаболизироваться и проходить через тело до достижения целевой области. Меньшие дозы – в диапазоне 1/300 пероральной дозы – могут означать меньшее количество побочных эффектов, повышение комфорта пациента и улучшение качества жизни.
Нейромодуляция, будь то электрическая или магнитная, использует естественный биологический ответ организма, стимулируя активность нервных клеток, которые могут влиять на популяцию нервов, высвобождая медиаторы-передатчики, такие как дофамин, или другие химические соединения-посредники, такие как пептидное вещество P, которые могут модулировать возбудимость и паттерны возбуждения нейронных цепей. Также могут быть созданы более прямые электрофизиологические эффекты на нервные мембраны, такие как механизм действия электрического взаимодействия с нервными элементами. Конечный эффект – это «нормализация» функции нейронной сети от ее возбужденного состояния. Предполагаемые механизмы действия для нейростимуляции включают деполяризующую блокаду, случайную (стохастическую) нормализацию потенциала действия (нервного импульса), аксональную блокаду, уменьшение кератоза нервных импульсов и подавление колебаний нервной сети.2 Хотя точные механизмы нейростимуляции неизвестны, эмпирическая эффективность привела к широкому применению данного метода в клинической практике.
Существующие и новые методы лечения нейромодуляции также применяют при лекарственно-устойчивой эпилепсии3, при хронической головной боли и в функциональной терапии, начиная от мочевого пузыря и кишечника или контроля дыхания до улучшения сенсорных нарушений, таких как слух (кохлеарные имплантаты и слуховые имплантаты ствола мозга) и зрение (имплантаты сетчатки).4 Технические улучшения включают тенденцию к минимально инвазивным (или неинвазивным) системам; а также более мелкие и сложные устройства, которые могут иметь автоматическое управление с обратной связью5 и совместимость с магнитно-резонансной томографией.6
Нейромодуляционная терапия была исследована для лечения других хронических состояний, таких как болезнь Альцгеймера,78 депрессия, хроническая боль,910 а также в качестве дополнительного лечения при восстановлении после инсульта.1112
Методы инвазивной электрической нейромодуляции
Электростимуляция с использованием имплантируемых устройств вошла в использование в 1980-х годах, и методы ее применения продолжали развиваться и расширяться.13 Это методы, при которых требуется операция по размещению электрода. Стимулятор с батареей, похожий на кардиостимулятор, также может быть имплантирован или может оставаться вне тела.
Как правило, системы нейромодуляции передают электрические токи и обычно состоят из следующих компонентов: эпидуральный, субдуральный или паренхиматозный электрод, вводимые с помощью минимально инвазивных игл (так называемые чрескожные отведения) или открытое хирургическое вмешательство (хирургическая «лопатка» или «сеточные» электроды) или стереотаксические имплантаты для центральной нервной системы и имплантированный генератор импульсов (IPG). В зависимости от удаленности от точки доступа к электродам в систему также может быть добавлен удлинитель. IPG может иметь либо неперезаряжаемую батарею, требующую замены каждые 2–5 лет (в зависимости от параметров стимуляции), либо перезаряжаемую батарею, которая пополняется через внешнюю индуктивную систему зарядки.
Хотя большинство систем работают через постоянную стимуляцию, в настоящее время появилась так называемая стимуляция с прямой связью, когда активация устройства зависит от какого-нибудь физиологического состояния, такого как, например, эпилептический припадок. В этом случае устройство активируется и доставляет десинхронизирующий импульс в область коры головного мозга, в которой находится эпилептогенный очаг. Эта концепция стимуляции с прямой связью, вероятно, станет более распространенной по мере обнаружения и проверки физиологических маркеров целевых заболеваний и нервных расстройств.14 Стимуляция по требованию может способствовать увеличению срока службы батареи, если требования системы к обработке сигналов будут достаточно энергоэффективны. Новые конструкции электродов могут обеспечить более эффективную и точную стимуляцию, требуя меньшего тока и минимизируя нежелательную побочную стимуляцию. Кроме того, исследователи изучают возможность разработки небольших систем стимуляции, которые заряжаются по беспроводной связи, а не через электрический провод.15
Стимуляция спинного мозга
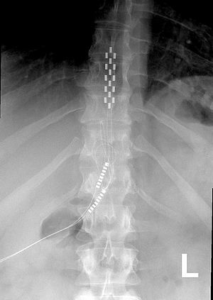
Стимуляция спинного мозга – это форма инвазивной нейромодуляционной терапии, широко используемая с 1980-х годов. Ее основное применение – это обратимая немедикаментозная терапия для лечения хронической боли, которая доставляет слабые электрические импульсы в спинной мозг.16 Пациентам, которые испытывают уменьшение боли на 50 процентов или более во время исследования, может быть предложен постоянный имплант, в котором, как и в случае с кардиостимулятором, имплантируемый генератор импульсов размером с секундомер помещается под кожу на туловище. Он подает слабые импульсы по тонким электрическим волокнам, ведущим к небольшим электрическим контактам размером с рисовое зерно в той области позвоночника, которую нужно стимулировать.17
Стимуляция обычно проводится в диапазоне 20–200 Гц, хотя сейчас появляется новый класс параметров стимуляции, в котором используется последовательность стимуляции до 10 кГц, а также «импульсная стимуляция» 500 Гц. Цепи килогерцовой стимуляции подсоединялмсь как к собственно спинному мозгу, так и к ганглию дорсального корешка у людей. Было показано, что все формы стимуляции спинного мозга имеют разную степень эффективности для лечения различных фармакорезистентных нейропатических или смешанных (нейропатических и ноцицептивных) болевых синдромов, таких как постламинэктомический синдром, боль в пояснице, комплексный регионарный болевой синдром, периферическая невропатия, заболевания периферических сосудов и стенокардия.18
Общий процесс стимуляции спинного мозга включает временное сопровождение соответствующих пациентов с помощью внешнего генератора импульсов, прикрепленного к эпидуральным электродам, расположенным в нижних отделах грудного отдела спинного мозга. Электроды устанавливаются либо с помощью минимально инвазивной игольной техники (так называемые чрескожные отведения), либо с помощью открытого хирургического вмешательства (хирургические электроды типа «лопатка»).
Отбор пациентов является ключевым моментом, и кандидаты должны пройти тщательный психологический скрининг, а также медицинское обследование, чтобы убедиться, что их болевой синдром действительно устойчив к лекарствам. После процедуры имплантации пациент подключается запрограммированной системе. В зависимости от системы программа может вызывать ощущение покалывания, которое покрывает большую часть болезненной области, заменяя некоторые болезненные ощущения более легким массажным ощущением, хотя другие более современные системы не создают ощущения покалывания. Пациента отправляют домой с портативным пультом дистанционного управления, чтобы выключить или включить систему или переключиться между предварительно заданными параметрами стимуляции, а затем можно будет следить за настройкой параметров.
Глубокая стимуляция мозга (DBS)
Еще одним инвазивным методом нейромодуляции, разработанным в 1980-х годах, является глубокая стимуляция мозга, которая может использоваться для уменьшения симптомов двигательного расстройства при болезни Паркинсона, дистонии или эссенциальном треморе.19 Глубокая стимуляция мозга была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в 1997 г. для лечения эссенциального тремора, в 2002 г. – для лечения болезни Паркинсона, а в 2003 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США исключило устройства для лечения двигательных симптомов дистонии.20 Метод был одобрен в 2010 году в Европе для лечения некоторых типов тяжелой эпилепсии.21 DBS также показала себя многообещающим методом, хотя все еще находится в стадии исследования, в отношении трудноизлечимых с медицинской точки зрения психических синдромов депрессии, обсессивно-компульсивных расстройств, трудноизлечимой ярости, слабоумия и патологического ожирения. Она также показала себя многообещающим методом при синдроме Туретта, кривошеи и поздней дискинезии. DBS-терапия, в отличие от стимуляции спинного мозга, имеет множество применений для центральной нервной системы, в зависимости от патологии. При болезни Паркинсона мишенями центральной нервной системы являются субталамическое ядро, внутренний бледный шар и вентральное промежуточное ядро таламуса. Дистонии часто лечат с помощью имплантатов, нацеленных на внутренний бледный шар или, реже, на вентральные ядра таламуса. Передний таламус – мишень для эпилепсии.2223 Слуховой имплант ствола мозга, который обеспечивает ощущение звука человеку, который не может использовать кохлеарный имплант из-за поврежденной или отсутствующей улитки или слухового нерва. Функциональная электростимуляция (ФЭС) Стимуляция блуждающего нерва (VNS)24 Стимуляция подъязычного нерва – вариант для некоторых пациентов с обструктивным апноэ во сне. Чрескожная стимуляция большеберцового нерва (PTNS) для лечения недержания мочи. Стимуляция периферических нервов (ПНС, которая относится к моделированию нервов за пределами позвоночника или головного мозга и может рассматриваться как включающая стимуляцию затылочного или крестцового нерва). Стимуляция затылочного нерва (ОНС). Стимуляция крестцового нерва (СНС) / нейромодуляция крестца (СНМ). В этих методах используются внешние электроды для подачи тока на тело, чтобы изменить работу нервной системы. Методы включают: Транскраниальная стимуляция постоянным током (tDCS) Чрескожная электрическая стимуляция нервов (TENS) и рецептурный вариант TENS, чрескожная афферентная паттерн-стимуляция (TAPS) Электросудорожная терапия (ЭСТ) Магнитные методы нейромодуляции обычно неинвазивны: для проникновения магнитного поля в тело не требуется хирургического вмешательства, поскольку магнитная проницаемость ткани аналогична проницаемости воздуха. Другими словами: магнитные поля очень легко проникают в тело. Эти два основных метода тесно связаны между собой, поскольку оба используют изменения напряженности магнитного поля для создания электрических полей и ионных токов в теле. Однако есть различия в подходе и оборудовании. В рТМС (Повторяющаяся транскраниальная магнитная стимуляция (рТМС)) стимуляция имеет высокую амплитуду (0,5–3 тесла), невысокую сложность и анатомическую специфичность достигается за счет сильнофокального магнитного поля. В tPEMF (Транскраниальные импульсные электромагнитные поля (tPEMF)) стимуляция имеет низкую амплитуду (0,01–500 миллитесла), высокая сложность и анатомическая специфичность достигается за счет специфической частотной составляющей сигнала.25 Химическая нейромодуляция всегда инвазивна, потому что лекарство доставляется в очень специфическое место тела. Неинвазивным вариантом является традиционная фармакотерапия, например когда мы просто проглатываем таблетку. Системы интратекальной доставки лекарств (ITDS, которые могут доставлять микродозы болеутоляющего (например, зиконотида) или лекарства против спазма (например, баклофена) непосредственно к месту действия). Электростимуляция нервной системы имеет долгую и сложную историю. Ранее практикующие глубокую стимуляцию мозга во второй половине 20-го века (Дельгадо, Хит, Хосбучи. Исторический обзор см. Хариз и др.26 ) были ограничены доступными технологиями. В 1950-х годах Хит стимулировал подкорковые области и детально наблюдал за изменениями поведения. Новое понимание восприятия боли было положено в 1965 году, когда появилась теория ворот Уолла и Мельзака.27 Хотя сейчас эта теория считается чрезмерно упрощенной, теория утверждала, что передачу боли от мелких нервных волокон можно преодолеть или «закрыть» ворота за счет конкурирующих передач по более широким волокнам сенсорного нерва. Основываясь на этой концепции, в 1967 году доктор Норм Шили из медицинской школы Western Reserve продемонстрировал первый стимулятор спинного отдела позвоночника для снятия боли с использованием конструкции, адаптированной Томом Мортимером, аспирантом Технологического института Кейса, на основе стимуляторов сердечного нерва компании Medtronic, Inc., где у него был профессиональный знакомый, поделившийся своей принципиальной схемой. В 1973 году Хосбучи сообщил об облегчении лицевой боли при денервации, вызванной психической анестезией, посредством постоянной электрической стимуляции соматосенсорного таламуса, что положило начало эпохе глубокой стимуляции мозга.2829 Несмотря на ограниченный клинический опыт этих десятилетий, эта эпоха примечательна демонстрацией роли, которую технологии играют в нейромодуляции, и есть несколько сообщений о случаях глубокой стимуляции мозга для решения множества проблем; реальные или предполагаемые. Дельгадо намекнул на силу нейромодуляции с помощью своих имплантатов в области перегородки крупного рогатого скота и на способность электрической стимуляции притуплять или изменять поведение. Дальнейшие попытки этой «модификации поведения» у людей были трудными и редко надежными, и способствовали общему отсутствию прогресса в нейромодуляции центральной нервной системы с той эпохи. Попытки лечения трудноизлечимых болевых синдромов увенчались большим успехом, но опять же были затруднены из-за качества технологий. В частности, так называемый «нулевой» электрод DBS (состоящий из контактной петли на конце) имел неприемлемую частоту отказов, и изменения были связаны с большим риском, чем пользой. В целом попытки использовать электрическую стимуляцию для «модификации поведения» были трудными и редко надежными, что замедляло развитие DBS. Ряд врачей, которые надеялись решить до сих пор неразрешимые проблемы, стремились разработать более специализированное оборудование; например, в 1960-х годах коллега Уолла Билл Суит нанял инженера Роджера Эйвери для изготовления имплантируемого стимулятора периферических нервов. Эйвери основал компанию «Эйвери», которая производила ряд имплантируемых стимуляторов. Незадолго до выхода на пенсию в 1983 году он представил данные, запрошенные FDA, которое начало регулировать медицинские устройства после совещания 1977 года по этой теме, касающегося DBS при хронической боли. Medtronic и Neuromed в то время также производили глубокие стимуляторы головного мозга, но, как сообщается, сочли, что комплексное клиническое испытание безопасности и эффективности у пациентов, которых трудно оценить, будет слишком дорогостоящим для размера потенциальной базы пациентов, поэтому не предоставили клинические данные по DBS для хронической боли в FDA, и это показание было отменено. Однако примерно в это время во Франции и в других странах DBS исследовали как замену поражению ядер мозга для контроля двигательных симптомов двигательных расстройств, таких как болезнь Паркинсона, и к середине 1990-х годов эта обратимая недеструктивная стимулирующая терапия стала применяться на практике: первичное применение DBS у соответствующих пациентов, чтобы замедлить прогрессирование двигательных нарушений от болезни и уменьшить побочные эффекты от длительного употребления лекарств.30 Параллельно с разработкой систем нейромодуляции для устранения двигательных нарушений, кохлеарные имплантаты были первой системой нейромодуляции, которая достигла широкой коммерческой стадии для устранения функционального дефицита; они обеспечивают восприятие звука пользователями с нарушением слуха из-за отсутствия или повреждения сенсорных клеток (ресничек) во внутреннем ухе. Подход к электростимуляции, используемый в кохлеарных имплантатах, вскоре был изменен одним производителем, Boston Scientific Corporation, для разработки электрических методов, которые будут использоваться при лечении состояний хронической боли с помощью стимуляции спинного мозга. В 2012 году глобальная фармацевтическая компания GlaxoSmithKline объявила об инициативе в области биоэлектрической медицины, в которой влияние вегетативной нервной системы на иммунную систему и воспалительные заболевания можно было бы лечить с помощью электростимуляции, а не фармацевтических препаратов. Первыми инвестициями компании в 2013 году стала небольшая стартап-компания SetPoint Medical, которая занималась разработкой нейростимуляторов для лечения воспалительных аутоиммунных заболеваний, таких как ревматоидный артрит.313233 В конечном счете, метод электрокосевтики направлен на обнаружение электронейронной сигнатуры болезни и на клеточном уровне в режиме реального времени воспроизвести более нормальную электро-сигнатуру, чтобы помочь поддерживать нейронную сигнатуру в нормальном состоянии. В отличие от предыдущих методов нейромодуляционной терапии, этот подход не будет включать электрические провода, стимулирующие крупные нервы, спинной мозг или центры головного мозга. Это могут быть методы, которые появляются в семействе терапий нейромодуляции, такие как оптогенетика или некоторые новые нанотехнологии. Заболевания и состояния, которые обсуждались в качестве мишеней для будущей электроокевтической терапии, включают диабет, бесплодие, ожирение, ревматоидный артрит и аутоиммунные расстройства.34 Согласно исследованию рынка, проведенному Neurotech Reports, ожидается, что мировая индустрия устройств нейромодуляции вырастет с 8,4 млрд долларов в 2018 году до 13,3 млрд долларов в 2022 году. Рынок имплантированных спинномозговых стимуляторов для лечения хронической боли в 2014 году оценивался в 1,80 млрд долларов во всем мире, и ожидается, что в 2018 году он вырастет до 2,88 миллиарда долларов. Наблюдатели прогнозируют двузначные среднегодовые темпы роста отрасли в целом. В этом нет ничего удивительного, учитывая огромную численность потенциальных пациентов для лечения, о чем свидетельствует распространенность следующих заболеваний: На сегодняшний день нейромодуляция только начинает рутинно применяться в качестве терапии для должным образом отобранных пациентов в этих группах. По мере того, как технологии продолжают развиваться, а количество врачей растет, вероятность того, что нейромодуляционная терапия затронет жизнь людей, резко возрастет.Другие инвазивные электрические методы
Неинвазивные электрические методы
Неинвазивные магнитные методы
Инвазивные химические методы
История
Отношение к электроцевтике
Рынок нейромодуляции
Footnotes
International Neuromodulation Society, 1 октября 2013 года