Психология
Необходимость исполнительного контроля
Термин «исполнительный контроль» используется для обозначения контроля моторной функции и когнитивных действий, направленных на достижение определенных целей. Долгое время в нейропсихологии с исполнительным контролем связывали функцию лобных долей мозга. Как было предложено, необходимость в механизме контроля исполнения деятельности возникала в нестереотипных ситуациях, требующих вмешательства контролирующих систем: при выборе определенного действия из множества возможных, при подавлении несоответствующего действия, при удержании в рабочей памяти планируемого действия и его ожидаемого результата.
Исполнительный контроль также требуется и для оптимизации поведения. Принятие решения в пользу определенного действия происходит с учетом ожидаемого результата. Рассогласование между прогнозируемым и действительным результатом действия используется для оптимизации и коррекции поведения. Так, если не последовало ожидаемого вознаграждения, возникающая ошибка ожидания обусловливает изменение ранее сформированного паттерна поведения.
Типы исполнительных операций
В соответствии с современными представлениями при рассмотрении процессов исполнительного контроля выделяют несколько подкомпонентов. В одной из наиболее распространенных классификаций (Smith and Jonides, 1999) исполнительные процессы подразделяются:
- на внимание и подавление;
- управление задачами;
- планирование;
- мониторинг;
- кодирование.
Вместе с тем количество и точные функции выделяемых подкомпонент до сих пор являются предметом дискуссий. Последние исследования были сконцентрированы на изучении тех подкомпонент, которые относительно хорошо определяются как эмпирически, так и теоретически.
В рамках настоящей главы мы различаем следующие операции над действиями (табл. 1):
- селективные операции — вовлечение в действия и отвлечение от них;
- рабочая память;
- операции мониторинга.
Эти операции хорошо определяются на психологическом уровне. Предполагается, что данные операции обеспечиваются разными нейронными механизмами и отражаются в различных компонентах вызванных потенциалов (ВП), вызванных действиями.
Таблица 1. Классификация исполнительных операций
| Основные операции | Исполнительная функция |
|---|---|
| Операция вовлечения | Активация нейронов фронтально-теменной коры, ответственных за формирование репрезентации планируемого действия, для обеспечения возможности реализации данного действия |
| Операция отвлечения | Подавление активности нейронов фронтальной коры, ответственных за формирование репрезентации планируемого действия, для воздержания от исполнения действия |
| Рабочая память | Временное хранение информации о планируемых действиях (от нескольких минут до нескольких часов) для активного использования ее при операциях вовлечения и отвлечения |
| Операция мониторинга | Сравнение результата реализованного действия с ожидаемым. При наличии рассогласования инициируется новое действие для его устранения |
Связь с селекцией действий
На уровне нейронных сетей исполнительные функции определяются как операции, выполняемые над репрезентациями действий, которые хранятся в коре головного мозга. В действительности эти репрезентации — память о действиях и планы, связанные с ними. Фронтально-теменная нейронная сеть является местом локализации репрезентаций действий, активация которых обеспечивает доступ к хранящейся информации об этих действиях. Исполнительные функции рассматриваются как вычислительные процессы или алгоритмы обработки информации, которые вызывают активацию определенного действия в заданном интервале времени и сложившихся обстоятельствах или подавляют репрезентацию действия, ненужного в данной ситуации.
Как и любая сложная функция, исполнительные функции реализуются сложной системой мозга, состоящей из корковых и подкорковых структур, связанных между собой. В состав кортикальных структур входят теменные и фронтальные области. Работа нейронов этих областей регулируется параллельной циклической активностью, охватывающей структуры коры, имеющие связи с соответствующими частями базальных ганглиев, проецирующие свои связи на соответствующие ядра таламуса, которые, в свою очередь, реципрокно связаны с корой.
Базальные ганглии как «темный подвал» мозга
Анатомия
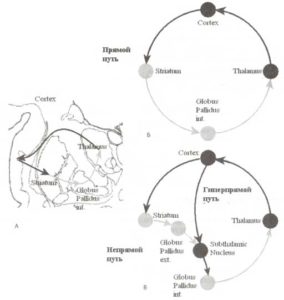
А. Анатомическая локализация таламуса и базальных ганглиев на коронарном срезе. В состав базальных ганглиев входят стриатум и бледный шар. Базальные ганглии и таламус расположены в непосредственной близости друг от друга. Связи между корой, базальными ганглиями и таламусом обозначены стрелками черного (возбуждающие) и серого (тормозные) цвета. Б. Схематическое изображение прямого проводящего пути базальных ганглиев. В. Непрямые и гиперпрямые проводящие пути базальных ганглиев.
Согласно мнению, высказанному Киннеаром-Вильсоном (Kinnear-Wilson) в 1920-х годах, ясность в работе базальных ганглиев подобна темному подвалу. И так было большую часть прошлого века. Только сравнительно недавно удалось продвинуться в понимании механизмов вовлечения базальных ганглиев в обеспечение реализации моторных, когнитивных и аффективных актов. В соответствии с классическим определением в состав базальных ганглиев входят пять ядер: хвостатое ядро, скорлупа, бледный шар (подразделяемый на внутреннюю и внешнюю части), субталамическое ядро и черная субстанция (рис. 1). Базальные ганглии являются самыми большими подкорковыми образованиями переднего мозга. Входными ядрами базальных ганглиев являются хвостатое ядро, скорлупа (вместе формируют стриатум) и прилежащее ядро. Эти ядра получают входы практически со всех областей коры, за исключением первичных. Выходные ядра базальных ганглиев, которые посылают результаты пространственного рекартирования и временной обработки к ассоциативным ядрам таламус, локализуются во внутренней части бледного шара. Ассоциативные таламические ядра также получают дополнительные входы от префронтальной коры, и затем реципрокно проецируют связи обратно в кору. Таким образом, базальные ганглии получают информацию фактически от всех областей коры обрабатывают ее и передают результаты обработки обратно в кору через таламические ядра.
Каждый из базальных ганглиев имеет важное клиническое значение. В частности, дегенерация нейронов стриатума приводит к болезни Нантингтона и соответствующим гиперкинетическим расстройствам. Ослабление продукции дофамина, возникающее в результате потери дофаминергических нейронов черной субстанции, вызывает паркинсонизм. Переизбыток О2-рецепторов дофамина является одним из признаков шизофрении. Синдром гиперактивности внимания характеризуется повышенным количеством DAT-рецепторов — рецепторов, ответственных за обратный захват дофамина в стриатуме. Бледный шар является структурой-мишенью при стереотаксических операциях и стимуляциях, применяемых в лечении парксинсонизма. Большое значение при лечении болезни Паркинсона имеют и субталамические ядра, являющиеся ключевыми структурами в процессах контроля функционирования выходных ядер базальных ганглиев (внутренняя часть бледного шара), электрическая стимуляция которых используется при лечении заболевания.
Прямые проводящие пути
Проводящие пути базальных ганглиев подразделяются на два вида: прямые и непрямые. Эти пути выполняют разные функции. Прямой проводящий путь (рис. 1 вверху справа) обеспечивает фокусированное подавление активности нейронов выходных ядер базальных ганглиев. Внутренняя часть бледного шара, являющаяся выходной структурой базальных ганглиев, оказывает тормозные контролирующие влияния на таламус (рис. 1 вверху справа), моторные ядра ствола мозга и верхние бугорки четверохолмия (на рис. 1 не показаны). В отличие от нейронов стриатума фоновая импульсная активность нейронов бледного шара очень интенсивна, что лежит в основе угнетающего действия на нейроны таламуса. Подавление этих тормозных влияний (называемых растормаживанием) выполняет воротную функцию, т.е. позволяет нейронам таламуса активироваться в ответ на внешнюю стимуляцию.
Следовательно, прямой проводящий путь обеспечивает положительную обратную связь с префронтальной корой. И действительно, увеличение активности префронтальной коры приводит к увеличению активности нейронов стриатума и подавлению нейронов бледного шара, что вызывает растормаживание нейронов таламуса и в конечном итоге способствует еще большей активации префронтальной коры. На уровне таламуса операция растормаживания может быть сравнима со снятием «тормоза», «удерживающего» активность нейронов таламуса. Таким образом, архитектура прямого проводящего пути базальных ганглиев предполагает, что его основная функция — управление активностью группы нейронов целевой системы через механизм растормаживания.
Регистрация активности глубоких структур мозга у пациентов
В лаборатории Института экспериментальной медицины РАМН на протяжении почти 20 лет изучалась импульсная активность нейронов и локальные потенциалы поля у пациентов, страдающих болезнью Паркинсона, эпилепсией и навязчивыми состояниями (обсессивно-компульсивное расстройство, ОКР). Все исследования проводились в диагностических и терапевтических целях, после стереотаксической имплантации электродов в структуры мишени. Стереотаксические операции проводились только в тех случаях, когда традиционные и более щадящие методы были малоэффективны в лечении. Пациенты с вживленными электродами принимали участие в различных исследованиях, построенных таким образом, чтобы изучать исполнительные функции.
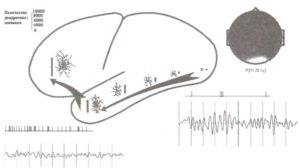
При регистрации импульсной активности в базальных ганглиях, вентральном таламусе и премоторной коре мы столкнулись с большим количеством подготовительных компонент, т.е. компонент, относящихся к подготовке реализации действия или восприятия стимула. Такие вызванные нейронные ответы наблюдались только на поведенчески значимых стимулах (рис. 2).
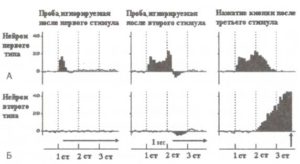
А. Пример импульсной активности нейронов при обработке сенсорной информации. Б. Пример нейронной активности при подготовке к моторной реакции. На графиках по горизонтальной оси отмечено время, по вертикальной — частота разрядов нейронов (в относительных величинах). Регистрация импульсной активности при помощи имплантированных электродов производилась у пациента, страдающего болезнью Паркинсона. Каждая проба тестового задания состояла из трех стимулов, представленных в нижней части рисунка: 1-й стимул определял, будет ли пациент ждать следующий стимул пробы или игнорировать ее целиком; 2-й стимул определял, нужно или нет нажимать кнопку, 3-й стимул служил триггерным сигналом для запуска моторной программы ответа (см. Kropotov et al., 1997).
Другой удивительной находкой был разный характер импульсной активности таламуса при предъявлении сигнальных GO и NOGO-стимулов. Так, GO-стимулы обычно вызывали активацию нейронов таламуса с латентностью около 200 мс, тоща как NOGO-стимулы, напротив, подавляли их активность (рис. 3). Эти реакции нейронов часто сопровождались соответственно позитивными (GO) и негативными (NOGO) компонентами локальных потенциалов, регистрируемых с одних и тех же электродов.
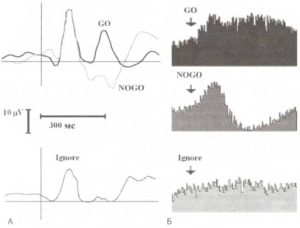
А. Интракраниальные ВП. Б. Ответы таламических нейронов на GO-, NOGO- и игнорируемые стимулы трехстимульной oddball-парадигмы. (А): по оси Y — усредненные потенциалы, которые были зарегистрированы с электродов, имплантированных в вентральную область таламуса в ответ на GO- (черная линия), NOGO- (серая линия) и игнорируемые (Ignore, внизу) стимулы. (Б): по оси Y — усредненная импульсная активность нейронов, зарегистрированная с тех же электродов. По оси X — время (неопубликованные данные из архивов лаборатории).
На основании ранее полученных данных была сформулирована теория программирования действий (Kropotov, 1987). В соответствии с данной теорией ключевую роль в выборе действий играет система таламокортикальных связей базальных ганглиев. Схематическая иллюстрация теории представлена на рис. 4.
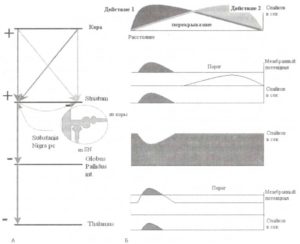
А. Схематическое отображение нейронов коры, стриатума, бледного шара и таламуса, а также их связей. Возбуждающие связи обозначены «+», тормозные обозначены «-». В овальной вставке изображен дендрит нейрона стриатума с дистальным синапсом от глугаматергического нейрона коры и синапсом от дофаминергического нейрона черной субстанции, расположенным проксимально. Б. Схематическое представление пространственных паттернов активаций на разных уровнях системы, объединяющей базальные ганглии и их таламокортикальные связи. На уровне коры мозга — перекрывающиеся отображения двух активированных действий. На уровне стриатума — две активированные программы действий картированы в разных частях стриатума. В силу сильной выраженности эффекта латерального торможения выбирается только одна из программ действий в соответствии с принципом «победитель получает все». На уровне бледного шара — спонтанная активность нейронов, которая соотносится с выбранной программой действия, ингибируется. На уровне таламуса соответствующие нейроны растормаживаются, что лежит в основе воротной функции таламуса, и при участии таламокортикального пути происходит интенсификация выбранной программы действия. Ось X — пространство. Порог — порог активации разрядов нейронов (см. Kropotov, Etlinger, 1999). Обозначения: SN — Substantia Nigra.
Модель выбора действий
Давайте представим ситуацию, когда из всего доступного репертуара действий нам необходимо выбрать одно, как, например, при правом или левом повороте на перекрестке. Пространственно распределенная активность, соответствующая кортикальному представительству каждого из действий, схематично представлена на рис. 4 (справа вверху). Данные активации существенно перекрываются на уровне премоторной и моторной коры (на рис. 4 горизонтальная ось обозначает пространственное расстояние). Полученные данные свидетельствуют о том, что каждая из распределенных нейронных сетей, соответствующая разным действиям, проецируется в разные области стриатума. На представленном рисунке две программы действий перекрываются на уровне коры, но по-разному проецируются в стриатум. Таким образом, стриатум сам по себе может быть представлен как «карта» действий.
Выходные нейроны стриатума по характеру воздействия тормозные. Они проецируются на нейроны бледного шара и одновременно посылают коллатерали на соседние нейроны стриатума, выполняя функцию латерального торможения. Механизм латерального торможения позволяет стриатуму выполнять специфическую фильтрующую функцию по принципу «победитель получает все». Фильтрация позволяет выбрать наиболее активированные репрезентации потенциальных действий и одновременно блокировать менее активированные (т.е. менее значимые в контексте данной ситуации).
Дофамин как модулятор активности базальных ганглиев
Дофамин, продуцируемый нейронами компактной части черной субстанции, модулирует активационные пороги эфферентных нейронов стриатума. Нейроны черной субстанции проецируются на проксимальные части синаптических шипиков, что обеспечивает положение, позволяющее существенно модулировать поток активаций от нейронов коры, которые имеют окончания на удаленных частях тех же синаптических шипиков (рис. 4, вставка). Известно, что дофаминовые рецепторы нейронов прямого проводящего пути базальных ганглиев — рецепторы D2-THna. Связывание дофамина с этими рецепторами вызывает активацию — медленную деполяризацию нейронов стриатума. Эффекторные нейроны, в свою очередь, реагируют только на активность, превосходящую порог срабатывания. Событие, превышающее этот порог, наблюдается в случаях, когда нейроны стриатума селективно деполяризуются нейронами коры (тогда как активность соседних нейронов подавлена) и глобально деполяризуется дофаминергическими проекциями из черной субстанции. Таким образом, наличие подавляющих латеральных связей стриатума формирует основу функции выбора действий. Кроме того, дофамин, в свою очередь, благоприятствует операциям по выбору действий, снижая пороги активации нейронов стриатума. В частности, при паркинсонизме отмечается наличие слишком высоких порогов активации, обусловленных дефицитом дофамина, что существенно затрудняет инициацию действий. При шизофрении, напротив, пороги срабатывания ненормально низки в силу высокой концентрации рецепторов дофамина в стриатуме, что приводит к одновременной активации нескольких программ и дезинтеграции сознания.
Растормаживание нейронов таламуса
Нейроны стриатума, входящие в состав системы выбора программ, проецируют свои связи в соответствующие области комплекса «бледный шар/черная субстанция» и подавляют их активность. Нейроны бледного шара и черной субстанции по сравнению с нейронами стриатума характеризуются высокочастотной спонтанной активностью. Следовательно, выбранное действие вызывает активацию нейронов стриатума и подавление высокочастотной активности нейронов бледного шара.
Нейроны бледного шара, в свою очередь, имеют связи с таламусом, за счет которых подавляют активность последнего. Так как нейронам бледного шара свойственна спонтанная активность, то таламус находится под постоянным тормозным влиянием. При ингибировании нейронов бледного шара уровень их импульсной активности снижается, что приводит к растормаживанию нейронов таламуса и активации таламокортикальных проводящих путей. Таким образом, таламус выполняет функцию «ворот», открывая доступ к коре для выбранного действия.
Используя известную «прожекторную» метафору Фрэнсиса Крика, можно сказать, что таламическая функция аналогична лучу прожектора, который выделяет и интенсифицирует выбранную программу на уровне коры.
Почему природа создала столь сложный механизм селекции действий? В соответствии с разработанной теорией (Kropotov, 1987) данный механизм обусловлен невозможностью одновременной активации (выделения) одного действия и торможения других исключительно на уровне коры. Дело в том, что все широко распределенные внутренние связи коры по своей природе активирующие, а кортикальное торможение может происходить только локально. Таким образом, мозг использует дополнительные механизмы, позволяющие выбирать действия на подкорковом уровне, а лишь потом усиливать и выделять действия на уровне коры.
Непрямые и гиперпрямые проводящие пути
В результате базально-таламокортикальных взаимодействий не только инициируются выбранные программы, но и подавляются нерелевантные. Торможение неподходящих действий осуществляется через непрямые проводящие пути, распространение активаций по которым приводит к противоположным эффектам в сравнении с прямыми путями (рис.1).
Суть нейронного механизма непрямого пути заключается в обеспечении фокусированных активаций на уровне выходных структур базальных ганглиев, оказывающих тормозные воздействия на возбудительные корковые и подкорковые структуры. Так, активация внутренней части бледного шара может приводить к подавлению подготовленной программы действий прямым способом, посредством торможения активности моторных ядер ствола мозга и верхних бугорков четверохолмия, или косвенным, посредством подавления нейронов таламуса, имеющих проекции на премоторные области коры. Известно также, что дофамин может модулировать распространение активаций по непрямым проводящим путям. Однако по сравнению с влиянием на прямые пути действие дофамина приводит к противоположным эффектам. Имеется в виду, что непрямые пути берут начало от нейронов стриатума, которые обладают D1-рецепторами (модуляция прямого пути осуществляется через D2-рецепторы). Связывание дофамина с D1-рецептором приводит к гиперполяризации мембраны, что и обусловливает торможение передачи. Таким образом, дофамин препятствует проведению информации на уровне непрямых проводящих путей (в то же время активируя передачу в прямом проводящем пути).
Гиперпрямой проводящий путь обеспечивает возбудительный эффект, оказываемый корой на бледный шар, в обход стриатума и характеризуется более короткой по времени проводимостью по сравнению с непрямыми путями. По всей видимости, функцией этого проводящего пути является подавление всех нерелевантных действий в момент выбора релевантного, осуществляемого с помощью проводящего пути.
Выходное влияние на ствол мозга
Нарушения в работе базальных ганглиев проявляются как неспособность не только инициировать и терминировать произвольные движения, но и прекращать непроизвольные. Кроме того, такие расстройства характеризуются ненормальными скоростью и количеством движений и мышечным тонусом. По всей видимости, базальные ганглии вносят вклад в поддержание мышечного тонуса и выполняют функцию «ворот» для моторной активности, что реализуется через влияние на моторную систему ствола мозга — базовую моторную систему, ответственную за поддержание тонуса мышц, поддерживающих положение тела, и локомоторную функцию.
Параллельные цепи
Известно, что практически любая область коры (за исключением первичных сенсорных зон) имеет проекции на стриатум. Наиболее обильными стриарными проекциями обладает префронтальная кора. Грубо говоря, эти проекции можно назвать топографически организованными. Однако они то-пографичны только при первом рассмотрении, поскольку более детальный анализ указывает на мозаичную форму проекций, позволяя любому нейрону префронтальной коры проецироваться на пространственно разные области стриатума. В то же время функционально связанные области коры (за счет внутренних кортикальных связей) проецируются в одну и ту же зону стриатума. Иными словами, на уровне стриатума представлена функциональная карта коры, а не ее топографические проекции. В соответствии с такой функциональной картой функционально связанные нейроны проецируются на конкретные области стриатума.
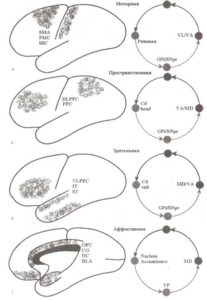
А—Г: моторная, пространственная, зрительная и аффективная петли связи коры и стриатума, которые участвуют в обеспечении выполнения и планирования моторных действий (моторная), организации пространственной и объектной рабочей памяти (пространственная, зрительная) и поддержании мотиваций и эмоций (аффективная). Обозначения: SMA — добавочная моторная область; РМС — премоторная кора; SSC — соматосенсорная кора; DLPFC — дорсолатеральная префронтальная кора; РРС — задняя теменная кора; VLPFC — вентралатеральная префронтальная кора; IT — нижняя височная кора; ST — верхняя височная кора; OFC — орбитофронтальная кора; CG — передняя поясная кора; НС — гиппокамп; BLA—базолатеральная амигдала; VP — вентральный паллидум; Gpi — внутренний сегмент бледного шара; SNpr — ретикулярная часть черной субстанции; VL — вентролатеральный таламус; VA — передний вентральный таламус; MD — медиодорсальный таламус; STN — субталамическое ядро; GPe — внешний сегмент бледного шара. Разных типы циклической активности включают разные части вышеперечисленных ядер (см. Alexander et al., 1986).
В соответствии с точкой зрения о разделении функций на уровне стриатума выделяют несколько параллельно работающих функциональных путей регуляции активности коры. Каждый из этих путей представлен пространственно разными областями на уровне коры, стриатума, бледного шара и таламуса. На основании своих анатомических и физиологических исследований Александер и Делонг в 1980-х годах выделили несколько типов параллельных проводящих путей: моторный, пространственный, зрительный и аффективный (рис. 5). Каждый из этих функциональных путей занимает специфическую часть стриатума и получает множественные, частично перекрывающиеся входы от нескольких анатомически связанных областей, участвующих в обеспечении одинаковых функций. Принимая во внимание названия этих путей, можно заключить, что они выполняют различные функции, а именно: выполнение и планирование действий (моторные), организация пространственной и объектной рабочей памяти (пространственные и зрительные), обеспечение мотиваций и эмоций (аффективные).
Моторный проводящий путь через ядро подушки осуществляет регуляцию активности моторной, премоторной и добавочной моторной коры. Также данный проводящий путь получает входы и от соматосенсорной коры. Эти цепи участвуют в инициации и подавлении моторных действий, а также в их подготовке. Некоторые специалисты отдельно рассматривают моторный и окуломоторный проводящий пути. С помощью окуломоторного пути обеспечивается регуляция активности области фронтальной коры, ответственной за движения глаз (фронтальное глазодвигательное поле), получающей также входы от задней части теменной коры (аналогичного теменного центра). Данный проводящий путь участвует в обеспечении ориентации тела и положения глаз в направлении выбранного источника сенсорной информации.
Удержание в памяти информации, касающейся пространственных стимулов, реализуется на уровне пространственного проводящего пути, объединяющего области дорсолатеральной префронтальной и задней теменной коры.
На уровне зрительного пути модулируется активность в области вентролатеральной префронтальной и латеральной височной коры, которые участвуют в реализации процессов регуляции рабочей памяти для объектов (в особенности зрительных).
В регуляцию настроения и эмоций вовлекаются структуры, входящие в состав аффективного проводящего пути: передняя поясная извилина, прилежащее ядро, орбитофронтальная кора и лимбические структуры аллокортекса (гипоталамус и энториальная кора).
Базальные ганглии, помимо проекций в вентральное, дорсомедиальное и переднее вентральное ядра таламуса, имеют связи с интраламинарными ядрами и ядрами срединной линии. Дополнительно эти ядра имеют сильные связи с холинергическими нейронами ретикулярной формации ствола мозга и обратные проекции как в область базальных ганглиев, так и во многие области коры. Высокочастотная стимуляция рассматриваемых ядер вызывает десинхронизацию скальповой ЭЭГ, сопровождающуюся реакцией возбуждения. К противоположным результатам приводит низкочастотная стимуляция — наблюдается постепенное нарастание медленной и веретенообразной волновой активности, ассоциирующейся с ослаблением внимания, сонливостью или сном.
ЭЭГ-корреляты нарушений базальных ганглиев
Известно, что функция базальных ганглиев тесно связана с движениями. С теоретической точки зрения ритмическая активность на уровне параллельных таламокортикальных проводящих систем активирует соответствующие области коры, что сопровождается десинхронизацией на скальповой ЭЭГ. Нарушения же, затрагивающие структуры, входящие в состав этих проводящих систем, должны приводить к синхронизации медленных осцилляций, регистрируемых непосредственно вблизи коры. Данные теоретические предположения подтверждаются экспериментальными данными.
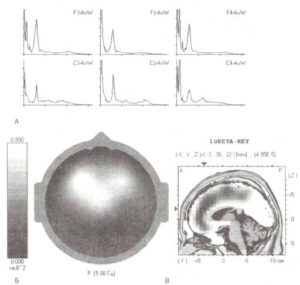
А. Спектральная мощность ЭЭГ с пиком для тета-ритма. Топограмма (Б) и локализация генераторов активности (В), вычисленная с помощью метода томографии низкого разрешения (sLORETA), относятся к тета-диапазону ЭЭГ (6 Гц), зарегистрированной у пациента на ранней стадии болезни Паркинсона.
В действительности было показано, что повреждение хвостатого ядра и нейронов скорлупы обезьян приводит к увеличению регулярной высокоамплитудной волновой активности частотой от 5 до 10 Гц. Сопоставимые эффекты наблюдаются и у пациентов, страдающих паркинсонизмом, вне зависимости от возраста или факта наличия деменции (рис. 6). Выраженность медленной активности зависит от степени моторной дисфункции в целом и акинезии в частности. Отмечается также снижение вызванной десинхронизации в ответ на произвольные движения пациентов с паркинсонизмом. При этом известно, что употребление L-DOPA может снимать эти патологические проявления, приводя ЭЭГ к нормальным значениям.
Префронтальная кора и исполнительный контроль
Анатомия
Лобные доли составляют примерно треть от всей коры больших полушарий мозга человека. Граница с теменной корой проходит по центральной борозде, а с височной — по сильвиевой борозде. Фронтальная кора не является унитарной структурой и подразделяется на первичную моторную кору (ПБ 4), электрические стимуляции которой могут приводить к мышечным сокращениям или простым движениям, премоторную и добавочную моторную область (ПБ 6), заднюю часть поясной извилины и префронтальную кору. Нейроны префронтальной коры реципрокно связаны дорсомедиальным ядром таламуса. Премоторная кора получает входы и проецируется обратно в латеральные таламические ядра. Поясная извилина имеет реципрокные связи с передним ядром таламуса.
Несмотря на то что вполне ясным представляется факт связи префронтальной коры с высшими когнитивными функциями, до сих пор остается непонятным, каким образом эти функции реализуются. Нейронная архитектура префронтальной коры, пожалуй, самая сложная по сравнению с другими областями коры, что позволяет рассматривать ее как субстрат высших когнитивных функций, получивших большее развитие у человека по сравнению с животными.
Префронтальная кора в составе нескольких проводящих путей получает множественные входы от мультимодальных сенсорных областей коры и лимбических структур мозга, проецирующиеся в разные зоны префронтальной коры. На рис. 7 схематично иллюстрирован информационный поток на уровне вентрального зрительного пути, достигающего лобной доли в области вентролатеральной префронтальной коры. В отличие от топографической организации проекций между областями задней части коры проекции префронтальной коры, строго говоря, не являются топографичными. Напротив, одна и та же область сетчатки имеет несколько представительств на поверхности префронтальной коры. Известны анатомические свидетельства, подтверждающие существование высокоупорядоченного паттерна терминалей аксонов, берущих начало в задних ассоциативных областях коры и оканчивающихся в префронтальной коре, формирующих чередующиеся, переплетенные полосы.
Сложность организации нейронных сетей
Первые исследователи в области сравнительной нейрофизиологии были впечатлены схожестью организации коры мозга млекопитающих. К несчастью, «схожесть» многими была понята как «одинаковость», и это привело к тому, что на протяжении второй половины прошлого столетия сложилось мнение об однообразном строении коры мозга. Считалось, что в целом кора (за исключением первичной зрительной коры) состоит из однородных и повторяющихся базовых элементов. В соответствии с этой догмой региональные отличия в обеспечении зрения, слуха и соматосенсорной чувствительности относили исключительно к разному составу входов и выходов.
Первые доказательства против эквипотенциальности были получены в исследованиях сенсорных систем. В период с 1980 по 1990 гг. было показано, что зрительная кора обезьян содержит около 30 областей. Исследования последних 10 лет свидетельствуют о том, что входящие и исходящие связи не являются единственной характеристикой специфичности процессов обработки информации зрительными областями коры. Особенности информационной обработки определяются также структурой связи нервных клеток (плотностью шипиков, паттерном ветвления дендритов и аксонов). Более того, внутренняя кортикальная структура различна для разных областей. Например, дендритное дерево третьего слоя пирамидных клеток в области ТЕ мозга макак содержит в среднем в 11 раз больше шипиков по сравнению с нейронами V1 зоны зрительной коры. Аналогичная картина характерна и для нейронов фронтальных областей: пирамидальные клетки префронтальной коры у человека и макаки в целом характеризуются наиболее разветвленными дендритами и большим количеством шипиков в сравнении с нейронами затылочной, теменной и височной долей (рис. 7).
Репрезентации сложных действий
Исходя из того что префронтальная кора получает множественные проекции от моторных областей коры, можно предполагать ее участие в хранении сложных репрезентаций действий. Считается, что дорсолатеральная префронтальная кора развивалась из моторных областей. Следовательно, вполне обоснованно считать, что функции более «новых» префронтальных моторных областей будут связаны с филогенетически более старыми структурами моторной системы. Недавно состоявшееся открытие зеркальных нейронов, активирующихся в ответ на реализацию как собственных действий, так и наблюдаемых действий других субъектов, поддерживает такую точку зрения.
Следует обратить внимание на то, что префронтальная кора ассоциируется не с действиями как таковыми, а с исполнительными функциями, т.е. контролем исполнения действий. При этом сложность поведения человека отождествляется со сложностью действий. Современные представления о степени функциональной дифференциации подобластей префронтальной коры, т.е. о том, насколько разные когнитивные функции могут картироваться разными областями, остаются противоречивыми. С одной стороны, в ситуациях, требующих когнитивного контроля, наблюдаются одновременные активации в дорсолатеральной, вентролатеральной и медиальной префронтальной коре. А с другой, рискуя увлечься неофренологией, некоторые исследователи склонны рассматривать разные подразделения префронтальной коры в качестве ключевых структур обеспечения разнообразных когнитивных функций, которые взаимодействуют между собой с целью оптимизации деятельности (например, при выполнении конкретных поведенческих задач).
Гиперфронтальность
Разная структура нейронных связей обусловливает специфичность импульсной активности нейронов. Исследования обезьян, проводимые Фастером и коллегами, позволили выявить различия свойств активности нейронов, локализующихся в VI и нижневисочных областях. Импульсная активность нейронов зрительной области носит фазический характер, тогда как клетки височной коры характеризуются тонической активностью (рис. 7). Такой устойчивый характер импульсной активности ассоциируется с процессами рабочей памяти и проявляется как гиперфронтальность — свойство, отражающее повышенную активированность фронтальной коры в сравнении с остальными кортикальными структурами. Этот эффект был открыт в работах шведского ученого Дэвида Ингвара в 1970-х годах.
Специфичность ЭЭГ
При рассмотрении ЭЭГ можно наблюдать разницу в активности между передними и задними отделами мозга (рис. 7). В частности, имеются в виду спектральные характеристики ЭЭГ. В состоянии покоя альфа-ритм регистрируется только в центрально-задних отведениях. В норме альфа-ритм не представлен в лобных областях. Ранние (до 200 мс) компоненты ВП, характеризующие зрительные процессы, обнаруживаются в затылочных и теменных отведениях, а поздние позитивные компоненты, ассоциирующиеся с операциями вовлечения и мониторинга действий, регистрируются во фронтальных и теменных отведениях.
Дофамин как медиатор исполнительных систем
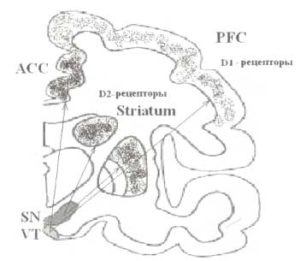
Черная субстанцая (SN) волокнами, входящими в состав дофаминергического проводящего пути, иннервирует стриатум (Striatum). Дофаминергический путь от вентральной области покрышки (VT) иннервирует области префронтальной коры (PFC), при этом наибольшее количество входов получают передние отделы поясной извилины (ACC).
Корковое и подкорковое распределение
Основным медиатором исполнительной системы является дофамин. Он продуцируется нейронами коры (префронтальная кора), а также подкорковыми структурами, входящими в состав исполнительной системы (например, стриатум). Распределение рецепторов к дофамину (ДА) на уровне префронтальной коры и стриатума показано на рис. 8. Наиболее богатую дофаминергическую иннервацию получает передняя поясная извилинa.
Дофаминергические системы
Сложность организации дофаминергической системы во многом обусловлена гетерогенностью исполнительной системы (рис. 8). Большинство дофаминсодержащих нейронов развиваются из одного типа эмбриональных клеток мезенцефально-диэнцефального стыка. Эти нейроны могут быть условно подразделены на два ядра с разными проекциями, которые и дают начало различным дофаминергическим системам мозга. Первая носит название нигростриар-ной дофаминергической системы, которая происходит из компактной области черной субстанции и проецируется в область стриатума. Другая система ассоциируется с вентральным тегментумом и известна как мезокортикальная дофаминергическая система. Нейроны медиальной области вентрального тегментума посылают обширные проекции в область медиальной префронтальной коры и поясной извилины. Оба типа нейронов получают обратную связь от областей, которые они иннервируют, таким образом формируя циклы реверберации соответствующих (префронтальной и стриарной) систем.
D1- и D2-рецепторы дофаминергических систем
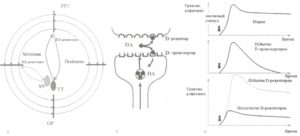
А. Схематическое изображение дофаминергический путей: 1) берущих свое начало в черной субстанции (SN) и иннервирующих стриатум с D2-рецепторами к дофамину; 2) от вентральной области покрышки (VT) до префронтальной коры (PFC) с D1-рецепторами. Б. Динамика дофамина в нейроне — появление значимого стимула вызывает высвобождение молекул дофамина из везикул, которые диффундируют в синаптическую щель и связываются с D-рецепторами постсинаптической терминали. «Вымывание» дофамина из синаптической щели осуществляется за счет механизма обратного захвата дофамина DAT-рецепторами пресинаптической терминали. В. В норме любой поведенчески значимый стимул вызывает формирование следа, время существования которого определяется временем присутствия дофамина в синаптической щели; при чрезмерной активности D-транспортеров, обеспечивающих слишком быстрый обратный захват дофамина, время удержания следа события сокращается; при недостатке D-рецепторов амплитуда следа уменьшается. Обозначения: DA — дофамин.
Описанные выше дофаминергические системы различаются и по типу рецепторов, наиболее характерных для каждой из них. Так, префронтальная кора характеризуется обилием рецепторов D1-семейства (D1 и D5). На уровне стриатума превалируют рецепторы D2-семейства (D2, D3 и D4; рис. 9).
Функции дофаминергических систем
Считается, что две дофаминергические системы (кортикальные и стриарные) выполняют разные функции. Нигростриарные дофаминергические проводящие пути устанавливают пороги активации нейронов стриатума и в соответствии с теорией, предложенной здесь, вовлекаются в процессы селекции действий и рабочей памяти. Дофаминергическая система среднего мозга модулирует мембранный потенциал нейронов префронтальной коры и передней поясной извилины и вовлекается в поддержание ряда функций, обеспечиваемых этими областями коры. Так, если говорить о ППИ, то это функция мониторинга действий. Функция префронтальной коры основывается на одном из основных качеств нейронов этой области, которое заключается в удержании следа действия или стимула в рабочей памяти. В действительности уже около 20 лет известно, что дофамин оказывает самое критическое действие на процессы рабочей памяти, основной вклад в обеспечение которых вносит префронтальная кора. Исследования обезьян и крыс показывают, что слишком слабая или, наоборот, сильная стимуляция дофаминергических рецепторов может приводить к нарушениям пространственной памяти. Клеточной основой хранения информации в рабочей памяти являются нейроны префронтальной коры, устойчивая активность которых обеспечивается оптимальным режимом активации D1-рецепторов.
Здесь следует упомянуть, что в отличие от глутамата (основного активирующего медиатора мозга) и ГАМК (основного тормозного медиатора), характеризующихся высокой скоростью передачи и короткой длительностью (несколько миллисекунд) действие дофамина в синаптической щели может длиться секунды или даже минуты, что определяется механизмом обратного захвата, обеспечиваемого специализированными рецепторами-транспортерами дофамина пресинаптической терминали (рис. 18). Причем чем больше таких рецепторов расположено на пресинаптической мембране, тем быстрее осуществляется захват дофамина и, следовательно, сокращается время активации, вызываемой значимым стимулом.
В отличие от DAT-рецепторов, определяющих динамические свойства действия дофамина, концентрация рецепторов D1 – и D2-семейства модулирует амплитуду эффекта дофамина. Так, например, снижение количества рецепторов к ДА на постсинаптической терминали обусловливает низкий уровень возбудимости нейронов стриатума и коры (или высокий порог активации). Наоборот, повышенная концентрация этих рецепторов на постсинаптической мембране (как, например, при шизофрении, когда отмечается избыточное содержание D2-рецепторов в стриатуме) приводит к снижению порогов активации нейронов стриатума.
Заключение
Под термином «исполнительные функции» понимают функцию контроля и координации моторных и когнитивных действий, направленных на достижение специфических целей деятельности. Считается, что механизмы исполнительного контроля необходимы в нестереотипных (нерутинных) ситуациях, требующих вмешательства контролирующих систем. Примерами таких ситуаций являются выбор адекватного действия из множества возможных, подавление несоответствующих действий, а также удержание в рабочей памяти как плана действий, так и представлений об ожидаемом результате. Исполнительный контроль необходим также и для оптимизации поведения. Исполнительные функции обеспечиваются сложной мозговой системой, состоящей из различных кортикальных и подкорковых структур, взаимосвязанных между собой. В состав кортикальных структур входит префронтальная кора, связанная с соответствующими областями теменно-височной коры. Нейронная активность этих областей регулируется параллельной циклической активностью, которая охватывает соответствующие области базальных ганглиев. Базальные ганглии проецируют свои связи в соответствующие ядра таламуса, которые, в свою очередь, имеют реципрокные связи с корой. Фактически замыкается петля обратной связи, охватывающей кору, базальныe ганглии и таламус. Стриатум является ключевым звеном этой системы и может рассматриваться как когнитивная карта репрезентаций действий, распределенных по соответствующим областям коры. Стриатум обеспечивает вы-бор действий с помощью механизма латерального торможения, оказывающего свое влияние на длительные дистанции. Фронтальные области коры характериются сложной архитектурой связей нейронов, что получает отражение в повышенном уровне их активности по сравнению с задними областями мозга. Совместно с базальными ганглиями области префронтальной коры вовлекаются в обеспечение исполнительных функций, заключающихся в операциях вовлечения, отвлечения, моторных операциях и рабочей памяти. Эти операции отражаются соответствующими компонентами ВП, которые могут генерироваться в условиях, модулируемых разными исследовательскими парадигмами, Например такими как oddball, GO/NOGO, а также тестовыми заданиями с привлечением рабочей памяти. Несмотря на известное перекрывание во времени и пространствe компонент ВП, связанных с исполнительными функциями, недавно разработанный метод анализа независимых компонент является мощным средством, позволяющим проводить их разделение. Использование нормативной HBI базы данных при регистрации ВП в рамках двухстимульной GO/ NOGO-парадигмы позволило выделить ряд компонент, связанных с исполнительными функциями: компоненты подавления моторной реакции и действия характеризовались фронтальной негативностью с латентным периодом 200 мс (известная N2-компонента подавления), компонента вовлечения — позитивностью в теменных областях и латентным периодом 300 мс (известная Р3b-компонента) и, наконец, компоненте, связанной с операциями мониторинга, соответствовала фронтально-центральная негативность с латентным периодом 400 мс. Использование метода томографии низкого разрешения (sLORETA) позволило выявить локализацию генераторов выделенных компонент ВП. Так, N2-компонента моторного подавления генерировалась в ипсилатеральной премоторной коре, а источник генерации компоненты мониторинга действий Р400 локализовался в области передней поясной извилины. Передняя поясная извилина также вовлекается в обеспечение генерации негативности, связанной с ошибкой — компонент, который регистрируется при навязанных тестовыми условиями ошибочных моторных ответах в условиях GO/NOGO-парадигмы. Главным медиатором исполнительной системы является дофамин. Продукция дофамина осуществляется на уровне нейронов префронтальной коры, а его действие опосредуется специфическими рецепторами D1 -типа. Дофамин также обнаруживается и в базальных ганглиях, где его действие связано с рецепторами D2-типа. Препараты, влияющие на разные этапы дофаминергической передачи, применяются для компенсации дисфункции исполнительной системы при шизофрении и СНВГ.