➥ Основная статья: Тета-ритмы
Тета-ритм (4—12 Гц) играет критически важную роль в процессах внимания и памяти, осуществляющихся с участием гиппокампа. В данном обзоре систематизированы данные о механизмах генерации тета-ритма, описать, какие структуры мозга вовлечены в его формирование и регуляцию.
Ритмы ЭЭГ были открыты в конце XIX века, однако по сей день они остаются одной из загадок, будоражащих умы исследователей мозга. Это связано с тем, что ритмы ЭЭГ тесно коррелируют с физиологическими состояниями мозга, а также с решением когнитивных задач.
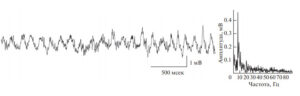
Среди всех отделов мозга млекопитающих гиппокамп очень быстро стал наиболее популярным объектом исследования, в том числе в контексте изучения ритмов. С одной стороны, гиппокамп имеет более простое анатомическое и гистологическое строение по сравнению с новой корой головного мозга. С другой стороны, гиппокамп вовлечен во множество когнитивных функций, таких как детекция новизны, внимание, декларативная (в том числе эпизодическая) память123. Наиболее выраженной электрической активностью, регистрируемой в гиппокампе, является тета-ритм — это высокоамплитудные осцилляции локального полевого потенциала с частотой 4—12 Гц (рис. 1). Тета-ритм является неизменным спутником процессов внимания и памяти, связанных с гиппокампом4. С самого момента открытия тета-ритма56 было понятно, что он представляет собой отражение синхронизации активности в обширных нейронных сетях гиппокампа. Однако возникает вопрос о том, является ли тета-ритм активным участником когнитивных функций или представляет собой их пассивное отражение, (т.е. не является ли тета-ритм эпифеноменом)? Другой важный вопрос заключается в выяснении механизмов, порождающих тета-ритм.
Медиальная септальная область – пейсмекер тета-ритма
На сегодняшний день в литературе утвердилось мнение, что медиальная септальная область (МСО) играет ключевую роль в генерации тета-ритма78. Эта точка зрения основывается на том, что удаление или фармакологическая инактивация активности в МСО нарушает гиппокампальный тета-ритм9101112, в то время как электрическая, фармакологическая или оптогенетическая стимуляция вызывают и усиливают его13141516. МСО содержит ГАМКергические, глутаматергические и холинергические нейроны17, при этом популяция ГАМКергических нейронов неоднородна и состоит из кальретинин- и парвальбумин-содержащих клеток181920. Для всех нейронных популяций, за исключением кальретинин-содержащих ГАМКергических нейронов, показаны проекции в гиппокамп2122.
В литературе ведется широкая дискуссия о роли каждой из групп септальных нейронов, проецирующихся в гиппокамп, в генерации тета-ритма. Наименее изученными остаются проекции глутаматергических нейронов. После открытия проекций этих нейронов к пирамидным клеткам и интернейронам гиппокампа некоторые авторы предполагали важную роль этих проекций в синхронизации гиппокампальной сети на тета-частоте. Однако последние исследования показывают, что внутрисептальные связи глутаматергических нейронов намного важнее, чем их проекции в гиппокамп23. В приведенной работе показано, что стимуляция аксонов глутаматергических нейронов, идущих в гиппокамп, не вызывает изменения мощности или частоты тета-ритма.
Холинергические септальные нейроны также имеют интенсивные проекции в гиппокамп. Основными мишенями холинергических проекций МСО в гиппокампе являются гранулярные клетки зубчатой фасции и пирамидные нейроны СА1 и СА3, однако холинергические терминали обнаруживаются и на интернейронах24. Показано, что холинергические нейроны МСО могут вовлекаться в ритмический режим25, однако их роль в регуляции тета-ритма гиппокампа до сих пор вызывает споры.
Долгое время считалось, что главный тип холинорецепторов в гиппокампе – это М3 мускариновые рецепторы26. Мускариновые рецепторы являются метаботропными, поэтому эффект их активации длится несколько десятков секунд или даже минут. Было показано, что активация холинергических проекций создает медленную деполяризацию нейронов СА127. Основываясь на этих данных, в литературе сложилось мнение, что роль холинергического входа заключается в создании тонического возбуждения. В последнее время появились данные о важности холинергических никотиновых рецепторов в когнитивных функциях гиппокампа28, однако пока не получено каких-либо данных об их роли в генерации тета-ритма29. В целом можно заметить, что влияние холинергических нейронов схоже с влиянием внешних проекций в МСО, таких как дофаминергические или серотонинергические, которые регулируют пейсмекерную функцию МСО. Роль внешних входов мы обсудим ниже.
В мировой литературе сложились представления, что главная роль в синхронизации гиппокампальной сети на тета-частоте принадлежит ГАМКергическим септо-гиппокампальным нейронам303132, экспрессирующим парвальбумин. ГАМКергические нейроны МСО селективно иннервируют интернейроны зубчатой фасции и полей СА3 и СА133. Показано наличие в МСО двух популяций парвальбумин-содержащих ГАМКергических нейронов, которые разряжаются ритмическими залпами на противоположных фазах гиппокампальной тета-волны, в противофазе относительно друг друга3435.
Следует отметить, что все перечисленные нейронные популяции МСО имеют интенсивные связи между собой и могут принимать участие в генерации тета-ритма не только с помощью прямых проекций в гиппокамп, но и за счет влияния на другие популяции нейронов внутри самой МСО36.
Регуляция пейсмекерной функции медиальной септальной области внешними проекциями
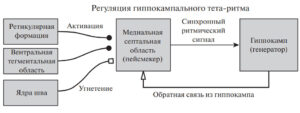
МСО получает многочисленные проекции из других областей мозга, которые влияют на ритмичность септальных нейронов (рис. 2). В литературе чаще всего обсуждаются проекции из гиппокампа, ретикулярной формации, супрамаммилярных ядер гипоталамуса, а также моноаминергические проекции. Многие из этих проекций регулируют мощность и/или частоту ритмической тета-активности в МСО37; подробно влияние указанных структур на ритмическую составляющую активности септальных нейронов описано ниже.
Обратная связь из гиппокампа осуществляется гиппокампально-септальными интернейронами. Они характеризуются экспрессией соматостатина, а также кальбиндина или кальретинина в поле СА1, в хилусе зубчатой фасции и в str. lucidum СА3 соответственно383940. В поле СА1 тела этих клеток находятся в str. oriens4142; эти интернейроны имеют горизонтальные дендриты и аксоны в других слоях (str. oriens, pyramidale и radiatum). Гиппокампально-септальные нейроны тормозят преимущественно парвальбумин-содержащие септальные нейроны434445. Таким образом, потенциально гиппокамп может оказывать прямое воздействие на выходной ритмический септальный сигнал. Некоторые авторы выдвинули идею, что для формирования синхронной активности нейронов в МСО необходим гиппокампальный вход, и тета-ритм генерируется в результате взаимодействия МСО и гиппокампа4647. Однако данная точка зрения не получила широкого экспериментального подтверждения. В работе, проведенной на септо-гиппокампальном препарате in vitro, было показано, что тормозный вход от гиппокампа может резонировать с парвальбумин-позитивными нейронами, имеющими h-токи, и за счет этого усиливать их ритмичность и синхронность48. Однако в данной работе для индукции тета-ритма использовалась аппликация карбахолина на гиппокампальную часть препарата, при котором генерируемая ритмическая активность на тета-частоте имеет другую, отличную от естественного тета-ритма, природу. Подробнее критику такого подхода в исследовании тета-ритма мы представим ниже. В другой работе при регистации in vivo было обнаружено, что при генерации тета-ритма наблюдается увеличение количества септальных нейронов, активность которых проходит статистический тест причинности по Грейнджеру по отношению к полевому сигналу, регистрируемому из гиппокампа49. Однако приведенные данные указывают только на наличие корреляционных отношений, что также не является прямым доказательством физиологической значимости гиппокампально-септальных проекций в генерации тета-ритма. Таким образом, вопрос о роли гиппокампально-септальных проекций в генерации тета-ритма остается открытым.
Большую роль в пейсмекерной активности МСО играет возбуждающий вход со стороны ретикулярной формации505152. Анатомически ретикулярная формация связана с МСО и гиппокампом группой волокон, входящих в состав медиального переднемозгового пучка53. Источник этих волокон находится в ядрах ретикулярной формации среднего мозга, ядрах Гуддена и ретикулярных ядрах покрышки моста. Волокна медиального переднемозгового пучка входят в МСО в области диагонального пучка Брока5455. Часть волокон напрямую проходит в дорсальном направлении в гиппокамп5657. Проекции ретикулярной формации среднего мозга имеют глутаматергическую природу585960. Ядра задней части среднего мозга и моста формируют холинергические проекции. Имеются данные, что часть проекций от ретикулярных ядер моста имеет ГАМКергическую природу.
Было показано, что электрическая или фармакологическая стимуляция ретикулярной формации приводит к увеличению частоты залпов септальных нейронов и увеличению частоты и мощности тета-ритма в гиппокампе616263646566. Вход со стороны ретикулярной формации рассматривается как источник информации о значимости сенсорного стимула; значимые стимулы активируют генерацию тета-ритма в гиппокампе, необходимого для процессов внимания и памяти.
Роль супрамаммилярного ядра гипоталамуса в генерации гиппокампального тета-ритма широко обсуждается в литературе. Показано, что нейроны супрамаммилярного ядра проецируются на холинергические и ГАМКергические нейроны МСО6768, а также в зубчатую фасцию и поле СА3 гиппокампа69. ГАМКергические нейроны, лежащие на границе медиального и латерального ядер септальной области, в свою очередь проецируются в супра-маммилярное ядро; таким образом, имеются сильные взаимные связи между септальной областью и супра-маммилярным ядром. Нейроны супрамаммилярного ядра разряжаются ритмичными залпами при генерации тета-ритма70717273; электрическая или фармакологическая стимуляция супрамаммилярного ядра увеличивает частоту и мощность гиппокампальных тета-осцилляций74. Однако этот эффект не наблюдается в том случае, если нейронная активность в МСО фармакологически заблокирована75. Удаление супрамаммилярного ядра не приводит к нарушению генерации тета-ритма в гиппокампе76. Основываясь на этих данных, в литературе выдвинута идея о том, что нейроны супрамаммилярного ядра могут резонировать с нейронами МСО, усиливая ритмичность последних77.
Серотонинергические проекции из медианного ядра шва подавляют нейронную активность в МСО и генерацию гиппокампального тета-ритма. Эта точка зрения подтверждается целым рядом исследований. Еще в 70-х годах было показано, что стимуляция ядра шва вызывает снижение мощности тета-ритма в гиппокампе и увеличение дельта-активности787980. Хирургическое удаление медианного ядра шва вызывает непрерывный гиппокампальный тета-ритм, не зависящий от внешних стимулов и поведения81. В то же время введение в боковые желудочки мозга флуоксетина, блокатора обратного захвата серотонина, повышающего уровень этого медиатора в мозге, снижало мощность тета-ритм в гиппокампе82. Проекции в септальную область от ретикулярной формации и от ядер шва рассматриваются как физиологические антагонисты83848586.
В МСО также обнаружены норадренергические проекции из голубого пятна (locus coeruleus)87. Показано, что норадренергическая система мозга играет важную роль в пробуждении, переключении внимания на внешние стимулы и т.д.88 Исходя из этого, можно было бы ожидать, что норадреналин должен усиливать тета-ритм. Однако ни стимуляция, ни блокада голубого пятна лидокаином или блокада норадренергических проекций не меняют мощность гиппокампального тета-ритма8990. Введение агонистов бета-адренорецепторов в МСО неанестезированных животных также не влияло на гиппокампальный полевой потенциал91. В то же время введение агониста клонидина в боковые желудочки мозга в низкой концентрации приводило к подавлению нейронной тета-активности и тета-ритма в гиппокампе, а высокие концентрации агониста оказывали противоположный эффект. Введение антагониста альфа-2 адренорецепторов идазоксана также зависело от используемой дозы препарата и было противоположным эффектом клонидина92. В целом можно говорить, что роль норадренергических проекций остается непонятной, однако весьма вероятно, что они играют важную роль в регуляции тета-осцилляций.
Дофаминергическое влияние усиливает гиппокампальный тета-ритм. МСО и гиппокамп принимают входы от вентральной тегментальной области, одного из главных источников дофаминергических проекций мозга. Показана важность активации дофаминергических рецепторов в синаптической пластичности в гиппокампе93. Введение дофаминергических агонистов в септальную область увеличивало мощность тета-ритма, но не изменяло его частоту94. Системное введение агониста дофаминергических рецепторов амфетамина увеличивало частоту гиппокампального тета-ритма; этот эффект подавлялся введением антагониста дофамина галоперидола95. Эти результаты согласуются с данными, полученными в другой работе, где внутримозговое введение (в боковые желудочки мозга) номифензина, блокатора обратного захвата дофамина, вызывало повышение тета-ритмичности септальных нейронов и тета-ритма в гиппокампе; в то же время введение антагониста дофаминовых рецепторов галоперидола оказывало противоположный эффект96. Также показано, что агонисты D1 и D2 рецепторов предотвращают снижение частоты тета-ритма, вызванное системным введением резерпина (неселективный агонист катехоламинов)97. В статье98 выдвинута гипотеза, что влияние дофаминергических проекций вентральной тегментальной области на тета-ритм может происходить не через МСО. Автор этой статьи предполагает, что дофамин может усиливать генерацию тета-ритма за счет подавления активности в базальных ганглиях и, как следствие, растормаживания таламического ядра реуниенс, которое в свою очередь имеет возбуждающие входы в поле СА1 и энторинальную кору. Также автор полагает, что торможение базальных ганглиев дофамином может увеличивать интенсивность холинергического входа в септальную область от холинергических ядер моста.
В заключение данного раздела стоит заметить, что вентральная тегментальная область, ядра шва и другие вышеупомянутые структуры взаимодействуют между собой, регулируются другими структурами мозга и получают обратную связь от гиппокампа, что также влияет на тета-ритм. В частности, холинергические проекции из пендункулопантийного ядра и латеродорзального тегментального ядра в вентральную тегментальную область увеличивают частоту разрядов ее дофаминергических нейронов и мощность тета-ритма в гиппокампе99100. В целом обсуждение взаимодействия перечисленных структур выходит за рамки данного обзора, мы можем лишь отослать читателей к обзору, полностью посвященному этой теме101.
Один или два ритма?
С самого начала исследования тета-ритма появилась гипотеза, что тета-ритм не единый процесс, а представляет собой два ритма. Эта точка зрения зародилась после появления данных, что тета-ритм у неподвижных животных и животных под уретановой анестезией подавляется антагонистами мускариновых рецепторов, в частности атропином, а у животных в свободном исследовательском поведении нет102. Предполагалось, что атропин-чувствительный тета-ритм возникает посредством прямого возбуждения пирамидных нейронов холинергическими проекциями из МСО, а атронин-независимый определяется ГАМКергическими септальными проекциями, при этом атропинчувствительный тета-ритм низкочастотный (4—9 Гц), а атропин-нечувствительный более высокочастотный (7—12 Гц)103. Дальнейшие исследования показали, что хирургическое удаление энторинальной коры приводит к падению мощности тета-ритма в str. lacunosum-moleculare поля СА1. В ходе исследовательского поведения животных оставшийся тета-ритм у прооперированных крыс подавлялся атропином, а у контрольных животных влияние атропина на мощность тета-ритма не было выявлено. В дальнейшем было показано, что уретан подавляет возбуждение и в том числе вход от энторинальной коры104. Недавние исследования показали, что из глубоких слоев энторинальной коры в МСО приходит сигнал о скорости движения, что приводит к тому, что частота разрядов септальных нейронов коррелирует со скоростью движения животного105106107. Это по всей видимости объясняет увеличение мощности и частоты тета-ритма в активном исследовательском поведении, и, наоборот, снижение частоты тета-ритма в ситуации, когда животное находится в покое или под анестезией108. На сегодняшний день вопрос о двойственности тета-ритма не решен. Одни исследователи считают, что тета-ритм подразделяется на два ритма, поскольку эти ритмы отличаются нейромедиаторными механизмами и поведенческими коррелятами. Другие исследователи считают, что тета-ритм — это единый процесс, который может запускаться разными сигналами, приходящими в МСО, в частности входом от энторинальной коры, входом от ретикулярной формации или дофаминергическим входом от вентральной тегментальной области (регуляция тета-ритма разными входами обсуждается выше). Эта точка зрения подтверждается также тем, что не показано принципиальных отличий в механизмах генерации тета-ритма в гиппокампе при разных условиях. Мы придерживаемся второй позиции и далее в статье будем считать, что тета-ритм — это единый ритм.
Роль коллатералей шаффера и перфорирующего пути в генерации тета-ритма в поле СА1 гиппокампа
Подавляющее количество данных о тета-ритме гиппокампа относится к полю СА1. Поэтому в этом и нескольких последующих разделах будет подробно обсуждаться генерация тета-ритма в поле СА1 как волны полевого потенциала. Затем будут сделаны уточнения относительно тета-ритма в других областях гиппокампальной формации.
Многие авторы считают, что входы от эн-торинальной коры и поля СА3 играют важную роль в генерации тета-ритма в поле СА1109110111112113114.
Все области гиппокампа и II—III слои энторинальной коры получают септальный вход; предполагается, что именно поэтому в них обнаруживается локальный тета-ритм, и активность нейронов в этих областях модулируется фазой тета-ритма115116117118. Активность пирамидных клеток поля СА3 сильнее “привязана” к фазе тета-ритма, чем таковая поля СА1. Выходной путь из поля СА3 через коллатерали Шаффера может напрямую вносить вклад в полевой потенциал поля СА1. Ранее было показано, что активация коллатералей Шаффера вызывает нисходящую фазу полевого потенциала в str. radiatum поля СА1119120. Пирамидные нейроны поля СА3 разряжаются на той же фазе тета-ритма, что и пирамиды СА1; это демонстрирует важный вклад работы коллатералей Шаффера в синхронизацию активности между полями СА3 и СА1.
Важность входа от энторинальной коры также находит подтверждение в многочисленных работах. Выше мы уже упоминали, что хирургическое удаление энторинальной коры вызывает резкое падение мощности тета-ритма в гиппокампе.
Главный возбуждающий вход в зубчатую фасцию и поле СА3 приходит из II слоя энторинальной коры, а именно, от звездчатых нейронов этого слоя121, в то время как проекции в СА1 в значительной степени приходят от III слоя энторинальной коры122123.
Нейроны энторинальной коры получают септальный вход от проекционных ГАМКергических нейронов124, поэтому тета-ритм в энторинальной коре хорошо выражен и нейроны, проецирующиеся в СА1, модулируются тета-ритмом. В работах125126127128 показано, что активность нейронов энторинальной коры “привязана” к полевому тета-ритму, регистрируемому не только в энторинальной коре, но и в СА1.
Данные о том, что нейроны III слоя энторинальной коры разряжаются на пике тета-волны, в то время как нейроны CA3 разряжаются на нисходящей фазе тета-ритма в СА1129, привели к идее, что моменты разрядов пирамидных нейронов CA1 определяются относительной силой кооперативного или конкурирующего сигналов из CA3 и энторинальной коры.
Следует заметить, что есть некоторая особенность в данных о привязке активности нейронов энторинальной коры и тета-ритма в гиппокампе. В работе130 показано, что сток тока, соответствующий возбуждающему току и в поле СА1, и зубчатой фасции возникает с большой задержкой 70—80 мс после разрядов нейронов в энторинальной коре, вместо ожидаемых 10 мс, рассчитанных на основе стандартной скорости проводимости по аксону. Такая большая задержка составляет больше половины тета-цикла, в результате сигнал приходит в другую фазу тета-ритма, в зависимости от текущей частоты тета-ритма.
В заключение данного раздела необходимо отметить, что при рассмотрении механизмов генерации других важнейших ритмов, а именно гамма-ритма и сверхвысокочастотных риппл-осцилляций в поле СА1, входы от СА3 и энторинальной коры рассматриваются как наиболее важные131132133. Таким образом, сигналы, идущие по коллатералям Шаффера и перфорирующему пути, оказывают значительное влияние на активность нейронов в СА1.
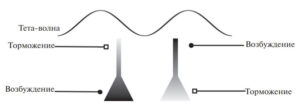
В данном разделе мы перейдем к обсуждению биофизического механизма генерации тета-ритма как ритмических колебаний полевого потенциала. Еще в 60-х годах ХХ века была выдвинута гипотеза, что природа ритмов заключается в токах, протекающих в экстраклеточном пространстве между слоями базальных и апикальных дендритов (рис. 3). Разность потенциалов, необходимая для генерации токов, возникает в результате разного заряда на теле и апикальном дендрите пирамид, которая в свою очередь образуется за счет ритмических постсинаптических токов, “заряжающих” компартменты пирамид134. Поскольку гиппокамп имеет упорядоченную структуру, то все токи суммируются и возникает относительно синхронный ритм135. С течением времени менялись точки зрения на то, какие именно входы на пирамидные нейроны имеют критическое значение для генерации тета-ритма. Однако точка зрения, что механизм продукции тета-ритма заключается в ритмических токах, которые создаются потенциалами между телами пирамид и апикальными дендритами, превалирует в современной литературе. Несмотря на то что почти все пирамидные нейроны могут вовлекаться в ритмическую активность, колебания мембранного потенциала остаются подпороговыми. Существует оценка, что менее 3% пирамидных нейронов СА1 разряжаются в течение одного тета-цикла136.
Токи через мембраны интернейронов не вносят значительного вклада в полевой потенциал, поскольку эти нейроны малочисленны по сравнению с пирамидными клетками и не имеют упорядоченных отростков137. Однако интернейроны могут играть роль в генерации тета-ритма посредством иннервации пирамид. Среди ГАМКергических нейронов гиппокампа выделяются две наибольшие группы. Первые тормозят перисоматическую зону пирамидных клеток и экспрессируют парвальбумин. Вторые тормозят апикальный дендрит пирамидных клеток и экспрессируют соматостатин. Следует заметить, что каждая из этих групп гетерогенная и включает множество подгрупп, в частности, в первой группе преобладают корзинчатые клетки, а во второй OLM-нейроны138139140. Многие авторы предполагают, что именно корзинчатые и OLM-нейроны играют критическую роль в генерации тета-ритма . Корзинчатые и OLM-нейроны проявляют наибольшую степень “привязки” своей активности к фазе тета-ритма, при этом корзинчатые нейроны разряжаются на нисходящей фазе тета-волны, а OLM-нейроны — на минимуме (впадине) тета-волны 141. Учитывая, что корзинчатые нейроны тормозят тело пирамид, а OLM нейроны — апикальный дендрит пирамидных нейронов, то, тормозя в противофазе тело и дендрит пирамид, корзинчатые и OLM-нейроны вызывают ритмические токи в экстраклеточном пространстве, которые и регистрируются как тета-ритм в гиппокампе. Убедительности этой точке зрения добавляет и тот факт, что разность фаз на тета-частоте между активностью проекционных септальных ГАМКергических нейронов соответствует разности фаз между активностью корзинчатых и OLM-нейронов. Этот факт свидетельствует, что существует селективность в связях септальных ГАМКер-гических нейронов, а именно, одна субпопуляция проекционных септальных ГАМКергических нейронов тормозит корзинчатые нейроны, а вторая — OLM-нейроны. Эта гипотеза объясняет ведущую роль МСО в генерации тета-ритма, а также то, как происходит передача ритмической активности в гиппокамп. Однако мы полагаем, что роль интернейронов в генерации тета-волны спорная. Главный аргумент против важной роли корзинчатых нейронов — это данные о привязке их активности к нисходящей фазе тета-ритма. Хорошо известно, что внутриклеточный потенциал на теле пирамидной клетки колеблется в противофазе с полевым тета-ритмом. Это следует из теоретических выкладок142 и показано экспериментально143. Следовательно, корзинчатые нейроны разряжаются во время деполяризации тел пирамидных нейронов, хотя известно, что ГАМКер-гические корзинчатые нейроны тормозят тела пирамид. Таким образом, мы приходим к явному противоречию. Эту точку зрения подтверждает экспериментальный факт, что торможение корзинчатых нейронов методами оптогенетики не приводит к падению мощности тета-ритма у животных в состоянии активного исследовательского поведения144. Стоит отметить, что в экспериментах in vitro получены противоположные результаты. В работе145 показано, что стимуляция корзинчатых нейронов усиливает ритмичность на тета-частоте, в то же время торможение этих нейронов, напротив, подавляет полевой тета-ритм. Это также указывает на различия в генерации тета-ритма в экспериментах in vivo и in vitro.
Аналогичные рассуждения на основе анализа фазовой привязки клеточной активности к фазе тета-волны можно привести и для OLM-нейронов. Если бы OLM-нейроны играли критическую роль в формировании тета-волны, они должны были бы разряжаться на нисходящей фазе тета-ритма, т.е. в фазу гиперполяризации апикальных дендритов. Экспериментальные данные свидетельствуют, что OLM-нейроны разряжаются на минимуме тета-волны, при этом с небольшой тенденцией к смещению их активности на восходящую фазу тета-ритма146. Это наводит на мысль о том, что и OLM-нейроны не играют важной роли в генерации тета-ритма. В исследовании in vitro147 , в котором было показано, что ни стимуляция, ни торможение OLM-нейронов не оказывали никакого влияния на мощность полевого сигнала в тета-диапазоне. Таким образом, роль OLM-нейронов в формировании тета-волны также остается неясной.
Из приведенных выше рассуждений не следует, однако, что интернейроны не принимают участие в формировании тета-волны. Вполне вероятно наличие в гиппокампе тех или иных популяций интернейронов, вносящих вклад в генерацию тета-ритма. Например, под предложенные критерии подходят холецистокинин-содержащие корзинчатые нейроны. Они тормозят перисоматическую зону пирамид и разряжаются на восходящей фазе тета-ритма, т.е. в фазу гиперполяризации тел пирамидных клеток148, что позволяет высказать гипотезу о важной роли этих интернейронов в генерации тета-волны. С другой стороны, можно предполагать, что все интернейроны принимают определенное участие в генерации тета-волны посредством контроля активности пирамидных нейронов. Как упоминалось выше, только малая часть пирамидных нейронов дает потенциалы действия в ходе одного тета-цикла, хотя почти все нейроны вовлечены в подпороговые осцилляции149. Вероятно, именно такой паттерн активности пирамидных нейронов важен для когнитивных процессов, когда интернейроны тормозят пирамидные клетки и поддерживают подпороговый характер колебаний.
В предыдущем разделе мы приводили данные о важности входов от поля СА3 и энторинальной коры для генерации тета-ритма в поле СА1. Важно отметить, что коллатерали Шаффера возбуждают проксимальную часть апикального дендрита пирамидных нейронов, а перфорирующий путь — его дистальную часть150. Кроме того, имеющиеся данные указывают на то, что сигналы на тета-частоте от СА3 и энторинальной коры приходят в противофазе относительно друг друга 151. Таким образом, можно выдвинуть гипотезу, что ритмические токи в экстраклеточном пространстве, определяющие волну тета-ритма, могут возникать в результате поочередного ритмического возбуждения тела и дистальной части апикального дендрита пирамид. Эта гипотеза имеет косвенные подтверждения. В частности, она подтверждается анализом пространственной когерентности полевых потенциалов на тета-частоте, зарегистрированных в разных в полях гиппокампа (СА3 и СА1), а также в энто-ринальной коре152. Кроме того, есть свидетельства, что сигнал от СА3 приходит во время нисходящей фазы тета-ритма, т.е. в момент деполяризации тел пирамидных клеток153. Однако прямых экспериментальных доказательств нам найти не удалось. Таким образом, в литературе не существует единого мнения об источниках возникновения экс-траклеточных токов при генерации тета-ритма.
Особенности тета-ритма в поле СА3 гиппокампа, зубчатой фасции и энторинальной коре
Тета-ритм выражен во всех областях гиппокампа и во всех слоях энторинальной коры; при этом наблюдается высокая попарная когерентность между всеми областями на тета-частоте154155156157. Подавляющее количество данных о механизмах генерации тета-ритма относится к полю СА1, а данных относительно других перечисленных областей гораздо меньше.
Поле СА3 гиппокампа по наличию нейронных популяций и связей между ними наиболее близко к полю СА1. Фазовые привязки к тета-волне пирамидных, корзинчатых и OLM нейронов очень близки к тем, что наблюдают в СА1158159. Так же, как и в СА1, колебания внутриклеточного потенциала пирамидных нейронов СА3 являются подпороговыми, и лишь около 1% нейронов разряжаются потенциалами действия в ходе тета-цикла160161162. Поле СА3 получает сходный с СА1 по структуре вход из МСО163. Кроме того, поле СА3 получает вход от зубчатой фасции, очень схожий с коллатералями Шаффера, приходящими из СА3 в СА1. Известно, что мшистые волокна из зубчатой фасции возбуждают перисоматическую зону пирамид СА3 и корзинчатые нейроны164165. На основе этих данных можно предполагать, что механизмы генерации тета-ритма в СА3 схожи с таковыми в СА1. Однако есть результаты, указывающие на важность ГАМКергическо-го входа от субикулума (части гиппокампальной формации) в генерации тета-ритма в СА3166. В данной работе показано в экспериментах in vivo и in vitro, что тета-осцилляции в субикулуме и СА3 сильно кор-релированы, при этом оптогенетическое торможение нейронов субикулума вызывает снижение мощности тета-ритма в поле СА3. Таким образом, механизмы генерации тета-ритма в СА3 могут иметь и некоторые отличия от таковых в СА1.
Зубчатая фасция наиболее слабо изучена в контексте механизмов тета-ритма. Показано, что мшистые клетки хилуса зубчатой фасции так же, как пирамидные нейроны СА1 и СА3, обнаруживают подпороговые осцилляции мембранного потенциала, в которых важную роль играют ГАМКА-токи167. Авторы предполагают, что это связано с тем, что перфорирующий путь в большей степени возбуждает интернейроны зубчатой фасции, нежели принципиальные нейроны. Следует отметить, что такая точка зрения находит подтверждение и в других работах168. Зубчатая фасция также получает интенсивный вход от МСО169170. В ряде других работ показана важность тета-ритма в зубчатой фасции для синаптической пластичности. Показано, что стимуляция перфорирующего пути на пике тета-ритма вызывает долговременную потенциацию, а на минимуме — долговременную депрессию или вообще не имеет эффекта171172173. Таким образом, несмотря на малое количество данных, можно утверждать, что тета-ритм в зубчатой фасции имеет важное функциональное значение.
Тета-ритм в энторинальной коре изучен достаточно детально. Латеральная энторинальная кора получает значительно меньше проекций из МСО, и тета-ритм в ней выражен в гораздо меньшей степени, чем в медиальной энторинальной коре174. В медиальной энторинальной коре септальные проекции в значительной степени обнаруживаются в II—III слоях, при этом показано, что септальные ГАМКергические нейроны селективно иннервируют интернейроны медиальной энторинальной коры175. В глубоких слоях медиальной энторинальной коры тета-ритм выражен слабее, и нейроны проявляют гораздо меньшую ритмику на тета частоте176.
Слои II—III медиальной энторинальной коры детально изучены благодаря открытию в них так называемых “клеток решетки” (grid cells)177. Известно, что во II— III слоях энторинальной коры присутствуют два типа принципиальных нейронов: пирамидные и звездчатые нейроны178. Звездчатые нейроны являются клетками решетки и проецируются в гиппокамп179. Пирамидные нейроны разряжаются на минимуме локальной тета-волны, в то время как активность звездчатых нейронов меньше привязана к фазе тета-ритма. Пирамидные нейроны энторинальной коры, так же как в СА1 и в СА3, проявляют подпороговые колебания мембранного потенциала, при этом потенциалы действия генерирует лишь около 1% клеток. Интернейроны также разряжаются около минимума тета-волны. Нам не удалось найти в литературе характеристик отдельных типов интернейронов в этой области энтори-нальной коры. В медиальной энторинальной коре также описана когерентность тета- и гамма-ритмов. Было показано, что при стимуляции звездчатых клеток на тета-частоте с помощью методов оптогенетики возникает гамма-ритм, который имеет максимальную мощность около минимума локальной тета-волны180. Все эти данные указывают на схожесть механизмов генерации тета-ритма в энторинальной коре с механизмами его генерации в гиппокампе. Однако очевидно, что тета-ритм в энторинальной коре имеет свою специфику, которая нуждается в изучении.
Тета-активность в переживающих срезах гиппокампа
Еще в конце 80-х годов было показано, что при действии карбахолина (агонист мускариновых рецепторов) на переживающих срезах гиппокампа генерируется полевая тета-активность181. Впоследствии эти результаты многократно повторялись, в том числе с другими сильными возбуждающими агентами, например, агонистами метаботропных глутаматергических рецепторов или NMDA182183184185186.
Известно, что генератор “карбахолинового тета-ритма” находится в поле СА3 гиппокампа, откуда он распространяется в СА1. Если в переживающем срезе разделить поля СА3 и СА1, то в поле СА1 ритмическая активность пропадает187. Возникающая тета-активность по некоторым параметрам похожа на тета-ритм, наблюдаемый у животных в свободном поведении. В частности, разряды нейронов разных клеточных популяций также проявляют привязанность к фазе тета-волны, наблюдается связанность тета- и гамма-осцилляций. Авторы открытия карбахолинового тета-ритма в своих работах188189190191192 даже предполагали, что тета-ритм может генерироваться только гиппокампальной сетью, без внешних входов, в том числе, входа от медиальной септальной области.
Однако данная точка зрения подверглась множественной критике. Было показано, что по ряду фармакологических механизмов карбахолиновый тета-ритм отличается от физиологического, наблюдаемого у животных in vivo. Форма волны полевого потенциала, регистрируемого под действием карбахола, резко отличается не только от тета-ритма, регистрируемого in vivo, но и от тета-ритма, регистрируемого в септо-гиппокампальном препарате in vitro при стимуляции МСО193. Активность пирамидных нейронов в ходе тета-волны также отличается для карбахолинового и физиологического тета-ритмов; в первом случае пирамидные нейроны разряжаются залпами194, во втором случае одиночными потенциалами действия195. При карбахолиновом тета-ритме практически все нейроны (и пирамиды, и интернейроны) синхронно разряжаются потенциалами действия, что резко отличается от физиологического тета-ритма, при котором колебания потенциала принципиальных нейронов остаются подпороговыми. Более того, при генерации тета-ритма показана низкая степень коррелированности моментов разрядов нейронов196, что также противоречит картине при аппликации карбахолина.
В теоретической литературе показано, что система из возбуждающих и тормозных нейронов склонна к синхронизации, в том числе на тета-частоте, при определенном наборе параметров связей и силе внешних возбуждающих входов197198199. Можно предполагать, что карбахолиновый тета-ритм является примером такой синхронизации. Убедительно показано, что блокаторы ГАМК–ергической передачи и AMPA-рецепторов подавляют карбахолиновый тета-ритм, при этом даже в присутствии блокаторов AMPA-рецепторов остаются ритмические разряды пирамидных клеток на тета-частоте. Эти данные приводят к мысли, что при блокаде синаптической передачи разряды нейронов не синхронизируются, что можно наблюдать как отсутствие полевых колебаний. Эта идея подтверждается многочисленными теоретическими исследованиями200201202. Таким образом, существуют принципиальные различия между физиологическим и карбахолиновым тета-ритмом. Все эти данные наводят на мысль, что активность, наблюдаемая при действии карбахолина, является патологической, похожей на эпилептические судорожные разряды.
Связь тета-ритма с другими ритмами
Кроме тета-ритма, наиболее выраженными ритмами в гиппокампе являются гамма-ритм (30—100 Гц) и риппл осцилляции (120— 400 Гц)203. Многими авторами гамма-ритм рассматривается как неоднородный, при этом некоторые авторы подразделяют гамма-ритм на две полосы: медленный (30—50 Гц) и быстрый гамма-ритм (60—90 Гц)204205; другие авторы выделяют дополнительно средний гамма-ритм (40—70 Гц)206. Следует отметить, что верхняя граница диапазона гамма-ритма различными авторами рассматривается в диапазоне от 90 до 150 Гц207. Несмотря на разногласия в оценках границ гамма-частот, многие авторы согласны с тем, что медленный и быстрый гамма-ритмы отличаются по своим механизмам генерации.
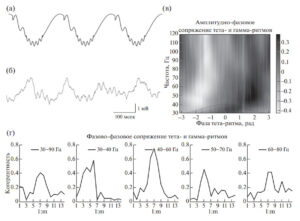
Гамма-ритм проявляет удивительную “привязку” к тета-ритму, регистрируемому в поле СА1 гиппокампа (рис. 4). Показано, что гамма-ритм генерируется не только в те моменты времени, когда выражен и тета-ритм, гамма-ритм привязан к определенной фазе тета-ритма, амплитудно и фазово. Медленный гамма-ритм генерируется на нисходящей фазе тета-ритма. Существует мнение, что медленный гамма-ритм генерируется в поле СА1 за счет входа от СА3; данная точка зрения опирается на экспериментальные факты о высокой когерентности на частоте медленного гамма-ритма между полями СА1 и СА3208209210211212.
Быстрый гамма-ритм также проявляет высокую степень привязки к тета-ритму в поле СА1. Быстрый гамма-ритм во время исследовательского поведения генерируется около минимума тета-волны, в то время как во время быстрого сна – на нисходящей фазе тета-ритма. Главным источником быстрого гамма-ритма в поле СА1 гиппокампа считается перфорирующий путь. Данная точка зрения основывается на высокой когерентности быстрого гамма-ритма в СА1 и в энторинальной коре. Вариабельность в привязке быстрого гамма-ритма к фазе тета-ритма, например в быстром сне, по всей видимости можно объяснить выше упоминавшейся задержкой в 70—80 мс в передаче сигнала от эн-торинальной коры в гиппокамп, которая при разной частоте тета-ритма будет давать разную задержку в фазах.
Кроме высокой степени привязки к фазе тета-ритма, быстрый и медленный гамма-ритмы демонстрируют фазовую привязку, иными словами можно сказать, что разность фаз между тета и гамма-ритмом остается постоянной. Разность фаз между ритмами принято оценивать с помощью n:m теста (рис. 4 (г)). В данном тесте n и m — это коэффициенты, на которые умножаются значения фаз ритмов перед нахождением разности; фазы предварительно могут быть рассчитаны стандартным способом, например, с помощью преобразования Гильберта. После нахождения разности фаз можно оценить длину вектора, полученного усреднением в полярных координатах всех векторов с единичной длиной и с углами, соответствующими полученной разности фаз. Значения n:m теста меняются от 0 до 1, что соответствует диапазону от полного отсутствия связи до полной связанности. На рис. 4 (г) приведен пример значений межчастотной когерентности в зависимости от n:m соотношения между частотами. Для всех частот гамма-ритма наблюдаются высокие значения n:m теста. Таким образом, и медленный, и быстрый гамма-ритм очень тесно связаны с тета-ритмом, они генерируются не только в определенную фазу тета-ритма, но и с определенной собственной начальной фазой.
Частота гамма-ритма во всех его диапазонах также хорошо коррелирует с частотой тета-ритма. Далее мы обсуждаем экспериментальный факт, что частота тета-ритма зависит от скорости движения животного в пространстве, и обсуждаем возможные механизмы этого явления. Связь частоты тета- и гамма-ритмов настолько сильная, что аналогичный эффект зависимости частоты от скорости движения животного наблюдается и для быстрого, и для медленного гамма-ритмов213.
Риппл-осцилляции, напротив, демонстрируют антагонистическое отношение к тета-ритму, они регистрируются в моменты времени, когда тета-ритм в гиппокампе не выражен214. Эти два типа осцилляций генерируются в гиппокампе во время противоположных функциональных состояний мозга: активном состоянии (тета-ритм) и состоянии покоя (риппл-осцилляции). При риппл-осцилляциях часто наблюдают активацию клеток места, часто в том порядке, в котором животное в дальнейшем двигается в лабиринте. Это рассматривают как планирование маршрута движения, однако во время бега в лабиринте чаще всего выражен тета-ритм215216217.
Некоторые работы указывают на то, что механизм антагонистических отношений может включать в себя влияние гиппокампа на МСО. Выше мы уже рассматривали свойства гиппокампально-септальных нейронов. Хотя отмечалось, что нет физиологических данных о важной роли этих нейронов для генерации тета-ритма, они могут быть вовлечены в генерацию риппл-осцилляций. Напомним, что гиппокампально-септальные нейроны получают возбуждение от пирамидных нейронов и легко вовлекаются в ритмические процессы, происходящие в гиппокампе218. Существуют данные, что оптогенетическая высокочастотная активация ГАМКергических гиппокампально-септальных нейронов приводит к длительному торможению нейронов МСО in vitro219. Это подтверждается данными in vivo: возникновение высокочастотных риппл-осцилляций в гиппокампе подавляет нейрональную активность в МСО220. Эти результаты указывают, что гиппокампально-септальные проекции могут участвовать в формировании риппл-осцилляций, временно подавляя нейронную активность МСО и генерацию тета-ритма. Это может быть важным механизмом обучения и памяти на сетевом уровне, поскольку показано, что во время риппл-осцилляций в гиппокампе осуществляются важные когнитивные функции, такие как консолидация памяти221.
Резюмируя, можно сказать, что в гиппокампе существует два режима нейрональной активности, регистрируемой в виде ритмов, а именно генерация тета- и гамма-ритма в одном режиме и периодически возникающие риппл-осцилляции в другом. В современной литературе в качестве механизмов возникновения гамма-ритма и риппл-осцилляций рассматривают внутренние свойства нейронных сетей гиппокампа и энторинальной коры, иными словами, гамма-ритм и риппл-осцилляции возникают вследствие локальных процессов, происходящих в нейронных сетях, а тета-ритм возникает вследствие пейсмекерного сигнала от МСО.
Распространение тета-ритма по септо-темпоральной оси гиппокампа
Мы уже отмечали, что во всех отделах гиппокампа наблюдается когерентный тета-ритм. Однако высокая когерентность наблюдается и между сигналами, регистрируемыми в поле СА1 дорсального и вентрального гиппокампа. В частности, было обнаружено очень интересное явление: сдвиг фаз тета-волны по мере движения по септо-темпоральной оси линейно увеличивается в зависимости от расстояния между регистрирующими электродами. Иными словами, тета-ритм распространяется по септо-темпоральной оси гиппокампа в виде “путешествующих” (бегущих) волн222. В дальнейшем это явление нашло подтверждение в работах других авторов223224, в том числе и в работах, проведенных в клинике на людях225. В экспериментах на крысах было показано, что разность фаз между крайними точками в дорсальном и вентральном гиппокампе может достигать 180°; при частоте тета-ритма 8 Гц и расстоянии между электродами в 10 мм можно получить значение скорости распространения тета-ритма в гиппокампе крыс в 0.16 м/с, что примерно соответствует скорости распространения “бегущих волн” в зрительной коре226. В работе на людях показано, что максимальный сдвиг фаз между дорсальным и вентральным полюсом гиппокампа составляет от 28° до 49°, что соответствует скорости распространения волны от 1 до 5 м/с.
В других работах было показано, что когерентность на гамма-частоте убывает значительно быстрее, чем на тета-частоте. При этом сила сопряженности между тета- и гамма-ритмом в септо-темпоральном направлении не меняется227228. Это указывает на то, что тета-ритм, в отличие от гамма-ритма, является глобальным процессом, в который вовлечен весь гиппокамп.
Еще одним интересным явлением является то, что частота тета-ритма в дорсальном и вентральном гиппокампе по разному реагирует на скорость и ускорение животного. Частота и мощность тета-ритма в поле СА1 и зубчатой фасции дорсального гиппокампа сильнее зависит от скорости и ускорения животного в линейном лабиринте229230. Также из других работ известно, что размер поля клеток места увеличивается в септо-темпоральном направлении231232. Все эти результаты подтверждают точку зрения, что дорсальный и вентральный гиппокамп выполняют разную функцию с точки зрения обработки информации. А именно, пространственная информация обрабатывается в большей степени в дорсальном гиппокампе, а непространственная в вентральном. Данная точка зрения также подтверждается данными о различной экспрессии генов в дорсальном и вентральном гиппокампе. Другим доказательством является различие в интенсивностях входящих и исходящих проекций в дорсальном и вентральном отделах гиппокампа. Дорсальный гиппокамп сильно связан взаимными связями с МСО, также он посылает интенсивные проекции в ретросплениальную и периринальную кору. Вентральный гиппокамп наиболее сильно связан с миндалиной и медиальной префронтальной корой233234.
В литературе обсуждаются три механизма распространения тета-волны по септо-темпоральной оси235236237. Первый механизм предполагает наличие одного генератора тета-ритма. В качестве такого генератора авторы наиболее часто рассматривают МСО. Эффект бегущей волны объясняется наличием задержек в распространении ритмического сигнала от генератора. Второе объяснение, которое приводится в процитированных выше статьях, заключается в предположении о распространении возбуждения по нейронной сети поля СА3. Эта точка зрения подтверждается данными, полученными на срезах поля СА3, в которых наблюдалось распространение возбуждения со скоростью, близкой к скорости распространения бегущей волны тета-ритма238. Последний гипотетический механизм предполагает распространение тета-волны как каскада синхронизации осцилляторов. Под осцилляторами понимаются пирамидные нейроны полей СА1 и СА3 и гранулярные нейроны зубчатой фасции. Как мы уже упоминали, в литературе имеется множество свидетельств того, что перечисленные нейроны проявляют спонтанные подпороговые колебания мембранного потенциала на тета-частоте. Показано, что частота и амплитуда этих колебаний у пирамидных нейронов СА1 уменьшаются в септо-темпоральном направлении239. Ритмические разряды одних нейронов могут вызывать подстройку соседних нейронов и т.д.
В заключение следует отметить, что все перечисленные механизмы пока не проверялись в экспериментах, поэтому невозможно сказать, какой из них наиболее вероятный. С другой стороны, они принципиально не противоречат друг другу, поэтому вполне вероятно, что они реализуются одновременно.
Заключение
Исследование механизмов генерации тета-ритма выявило, что для его формирования необходима связь гиппокампа с медиальной септальной областью (МСО). Часть нейронов этой области постоянно разряжаются залпами на тета-частоте (тета-пейсмекеры), вовлекая в ритмическую активность большинство клеток МСО при поступлении в мозг новой информации. Септальные нейроны имеют интенсивные проекции во все области гиппокампа. При отсутствии связей нейронных сетей МСО и гиппокампа тета-ритм в последнем не генерируется240241242243. Более того, пейсмекерная функция МСО регулируется проекциями от различных стволовых структур: серотонинергические проекции ядер шва подавляют тета-ритм, а глутаматергические проекции ядер ретикулярной формации и дофаминергические проекции из вентральной тегментальной области усиливают тета-ритм244245246247. Все это доказывает, что тета-ритм — это не эпифеномен, а важный физиологический процесс, зависящий от сохранности связей между многими структурами мозга, имеющий физиологические механизмы регуляции, и без генерации которого нарушаются процессы обучения и запоминания248249250251.
Читайте также
- Среднелобный тета-ритм
- Тета-ритм в процессах формирования памяти
- Тета-ритм при решении задач
- Генерация тета-ритма
- Тета (θ)-ритм и его происхождение
- тета-Активность
Footnotes
- Buzsaki G., Moser E.I. Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nat. Neurosci. 2013. 16: 130-138.
- Vinogradova O.S. Expression, control, and probable functional significance of the neuronal thetarhythm. Prog. Neurobiol. 1995. 45: 523-583.
- Vinogradova O.S. Hippocampus as comparator: role of the two input and two output systems of the hippocampus in selection and registration of information. Hippocampus. 2001. 11: 578-598.
- Buzsaki G. Theta oscillations in the hippocampus. Neuron 2002. 33: 325-340.
- Green J.D., Arduini A.A. Hippocampal electrical activity in arousal. J. Neurophysiol. 1954. 17: 533-557.
- Jung R., Kornmuller A.E. Eine Methodik der Ableitung Iokalisierter Potentialschwankungen aus subcorti-calen Hirngebieten. Archiv. f. Psychiatrie 1938. 109: 1-30.
- Colgin L.L. Mechanisms and functions of theta rhythms. Annu. Rev. Neurosci. 2013. 36: 295-312.
- Vertes R.P., Kocsis B. Brainstem-diencephalo-septo-hippocampal systems controlling the theta rhythm of the hippocampus. Neuroscience. 1997. 81: 893-926.
- Wang Y., Romani S., Lustig B., Leonardo A., Pastalkova E. Theta sequences are essential for internally generated hippocampal firing fields. Nat. Neurosci. 2015. 18: 282-288.
- Mitchell S.J., Rawlins J.N., Steward O., Olton D.S. Medial septal area lesions disrupt theta rhythm and cholinergic staining in medial entorhinal cortex and produce impaired radial arm maze behavior in rats. J. Neurosci. 1982. 2: 292-302.
- Mizumori S.J., Perez G.M., Alvarado M.C., Barnes C.A., McNaughton B.L. Reversible inactivation of the medial septum differentially affects two forms of learning in rats. Brain Res. 1990. 528: 12-20.
- Petsche H., Stumpf C. The origin of theta-rhythm in the rabbit hippocampus. Wien. Klin. Wochenschr. 1962. 74: 696-700.
- Lee D.J., Izadi A., Melnik M., Seidl S., Echeverri A., Shahlaie K., Gurkoff G.G. Stimulation of the medial septum improves performance in spatial learning following pilocarpine-induced status epilepti-cus. Epilepsy Res. 2017. 130: 53-63.
- Robinson J., Manseau F., Ducharme G., Amilhon B., Vi-gneault E., E.l., Mestikawy S., Williams S. Optoge-netic activation of septal glutamatergic neurons drive hippocampal theta rhythms. J. Neurosci. 2016. 36: 3016-3023.
- Sweet J.A., Eakin K.C., Munyon C.N., Miller J.P. Improved learning and memory with theta-burst stimulation of the fornix in rat model of traumatic brain injury. Hippocampus. 2014. 24: 1592-1600.
- Zutshi I., Brandon M.P., Fu M.L., Donegan M.L., Leutgeb J.K., Leutgeb S. Hippocampal neural circuits respond to optogenetic pacing of theta frequencies by generating accelerated oscillation frequencies. Curr. Biol. 2018. 28: 1179-1188.e3.
- Sotty F., Danik M., Manseau F., Laplante F., Quirion R., Williams S. Distinct electrophysiological properties of glutamatergic, cholinergic and GABAergic rat septohippocampal neurons: novel implications for hippocampal rhythmicity. J. Physiol. (Lond). 2003. 551: 927-943.
- Freund T.F. GABAergic septohippocampal neurons contain parvalbumin. Brain Res. 1989. 478: 375381.
- Kiss J., Patel A.J., Baimbridge K.G., Freund T.F. Topographical localization of neurons containing parv-albumin and choline acetyltransferase in the medial septum-diagonal band region of the rat. Neuroscience. 1990. 36: 61-72.
- Kiss J., Magloczky Z., Somogyi J., Freund T.F. Distribution of calretinin-containing neurons relative to other neurochemically identified cell types in the medial septum of the rat. Neuroscience. 1997. 78: 399-410.
- Manseau F., Danik M., Williams S. A functional gluta-matergic neuron network in the medial septum and diagonal band area. J. Physiol. (Lond). 2005. 566: 865-884.
- Mesulam M.M., Mufson E.J., Wainer B.H., Levey A.I. Central cholinergic pathways in the rat: an overview based on an alternative nomenclature (Ch1-Ch6). Neuroscience 1983. 10: 1185-1201.
- Robinson J., Manseau F., Ducharme G., Amilhon B., Vi-gneault E., E.l., Mestikawy S., Williams S. Optoge-netic activation of septal glutamatergic neurons drive hippocampal theta rhythms. J. Neurosci. 2016. 36: 3016-3023.
- Frotscher M., Leranth C. Cholinergic innervation of the rat hippocampus as revealed by choline acetyltransferase immunocytochemistry: a combined light and electron microscopic study. J. Comp. Neurol. 1985. 239: 237-246.
- Brazhnik E.S., Fox S.E. Action potentials and relations to the theta rhythm of medial septal neurons in vivo. Exp. Brain Res. 1999. 127: 244-258.
- Cummings J.L. Cholinesterase inhibitors: A new class of psychotropic compounds. Am. J. Psychiatry. 2000. 157: 4-15.
- Madison D.V., Lancaster B., Nicoll R.A. Voltage clamp analysis of cholinergic action in the hippocampus. J. Neurosci. 1987. 7: 733-741.
- McQuiston A.R. Acetylcholine release and inhibitory interneuron activity in hippocampal CA1. Front. Synaptic Neurosci. 2014. 6: 20.
- Stoiljkovic M., Kelley C., Nagy D., Hajos M. Modulation of hippocampal neuronal network oscillations by a7 nACh receptors. Biochem. Pharmacol. 2015. 97: 445-453.
- Freund T.F., Antal M. GABA-containing neurons in the septum control inhibitory interneurons in the hippocampus. Nature. 1988. 336: 170-173.
- Stewart M., Fox S.E. Do septal neurons pace the hippocampal theta rhythm? Trends Neurosci. 1990. 13: 163-168.
- Toth K., Freund T.F., Miles R. Disinhibition of rat hippocampal pyramidal cells by GABAergic afferents from the septum. J. Physiol. (Lond). 1997 (Pt 2). 500: 463-474.
- Unal G., Joshi A., Viney T.J., Kis V., Somogyi P. Synaptic targets of medial septal projections in the hippocampus and extrahippocampal cortices of the mouse. J. Neurosci. 2015. 35: 15812-15826.
- Borhegyi Z., Varga V., Szilagyi N., Fabo D., Freund T.F. Phase segregation of medial septal GABAergic neurons during hippocampal theta activity. J. Neurosci. 2004. 24: 8470-8479.
- Henderson Z., Fiddler G., Saha S., Boros A., Halasy K. A parvalbumin-containing, axosomatic synaptic network in the rat medial septum: relevance to rhythmogenesis. Eur. J. Neurosci. 2004. 19: 27532768.
- Dannenberg H., Pabst M., Braganza O., Schoch S., Niediek J., Bayraktar M., Mormann F., Beck H. Synergy of direct and indirect cholinergic septo-hippocampal pathways coordinates firing in hippocampal networks. J. Neurosci. 2015. 35: 83948410.
- Кичигина В.Ф. Механизмы регуляции и функциональное значение тета-ритма: роль серотонинергической и норадренергической систем. Журн. высш. нерв. деят. им. И.П. Павлова. 2004. 54 (1): 101-118.
- Gulyas A.I., Seress L., Toth K., Acsady L., Antal M., Freund T.F. Septal GABAergic neurons innervate inhibitory interneurons in the hippocampus of the macaque monkey. Neuroscience. 1991. 41: 381390.
- GulyasA.I., HajosN., Katona I., Freund T.F. Interneurons are the local targets of hippocampal inhibitory cells which project to the medial septum. Eur. J. Neurosci. 2003. 17: 1861-1872.
- Seress L., Gulyas A.I., Freund T.F. Parvalbumin- and calbindin D28k-immunoreactive neurons in the hippocampal formation of the macaque monkey. J. Comp. Neurol. 1991. 313: 162-177.
- Jinno S., Kosaka T. Immunocytochemical characterization of hippocamposeptal projecting GABAergic nonprincipal neurons in the mouse brain: a retrograde labeling study. Brain Res. 2002. 945: 219-231.
- Zappone C.A., Sloviter R.S. Commissurally projecting inhibitory interneurons of the rat hippocampal dentate gyrus: a colocalization study of neuronal markers and the retrograde tracer Fluoro-gold. J. Comp. Neurol. 2001. 441: 324—344.
- Bassant M.H., Simon A., Poindessous-Jazat F., Csaba Z., Epelbaum J., Dournaud P. Medial septal GABAer-gic neurons express the somatostatin sst2A receptor: functional consequences on unit firing and hippocampal theta. J. Neurosci. 2005. 25: 20322041.
- Mattis J., Brill J., Evans S., Lerner T.N., Davidson T.J., Hyun M., Ramakrishnan C., Deisseroth K., Hugue-nard J.R. Frequency-dependent, cell type-divergent signaling in the hippocamposeptal projection. J. Neurosci. 2014. 34: 11769-11780.
- Toth K., Borhegyi Z., Freund T.F. Postsynaptic targets of GABAergic hippocampal neurons in the medial septum-diagonal band of broca complex. J. Neu-rosci. 1993. 13: 3712-3724.
- Borisyuk R., Hoppensteadt F. Oscillatory models of the hippocampus: a study of spatio-temporal patterns of neural activity. Biol. Cybern. 1999. 81: 359-371.
- Denham M.J., Borisyuk R.M. A model of theta rhythm production in the septal-hippocampal system and its modulation by ascending brain stem pathways. Hippocampus. 2000. 10: 698-716.
- Manseau F., Goutagny R., Danik M., Williams S. The hippocamposeptal pathway generates rhythmic firing of GABAergic neurons in the medial septum and diagonal bands: an investigation using a complete septohippocampal preparation in vitro. J. Neurosci. 2008. 28: 4096-4107.
- Kang D., Ding M., Topchiy I., Kocsis B. Reciprocal Interactions between Medial Septum and Hippocampus in Theta Generation: Granger Causality Decomposition of Mixed Spike-Field Recordings. Front. Neuroanat. 2017. 11: 120.
- McNaughton N., Richardson J., Gore C. Reticular elicitation of hippocampal slow waves: common effects of some anxiolytic drugs. Neuroscience. 1986. 19: 899-903.
- Бражник Е.С., Виноградова О.С., Коранов А.М. Регуляция тета-активности нейронов септум кортикальными и стволовыми структурами. Журн. высш. нерв. деят. им. И.П. Павлова. 1984. 34: 71-80.
- Бражник Е.С. Сравнительные характеристики залповых нейронов септум при устранении восходящих влияний ретикулярной формации у кроликов (хирургическими и фармакологическими воздействиями). Журн. высш. нерв. деят. им. И.П. Павлова. 1986. 36: 721-729.
- Guillery R.W. Degeneration in the hypothalamic connexions of the albino rat. J. Anat. 1957. 91: 91-115.
- Conrad L.C., Pfaff D.W. Efferents from medial basal forebrain and hypothalamus in the rat. I. An autoradiographic study of the medial preoptic area. J. Comp. Neurol. 1976. 169: 185-219.
- Conrad L.C., Pfaff D.W. Efferents from medial basal forebrain and hypothalamus in the rat. II. An autoradiographic study of the anterior hypothalamus. J. Comp. Neurol. 1976. 169: 221-261.
- Raisman G. Neural connexions of the hypothalamus. Br. Med. Bull. 1966. 22: 197-201.
- Raisman G., Cowan W.M., Powell T.P. An experimental analysis of the efferent projection of the hippocampus. Brain. 1966. 89: 83-108.
- Ford B., Holmes C.J., Mainville L., Jones B.E. GABAergic neurons in the rat pontomesencephalic tegmentum: codistribution with cholinergic and other tegmental neurons projecting to the posterior lateral hypothalamus. J. Comp. Neurol. 1995. 363: 177-196.
- Steriade M. Arousal: revisiting the reticular activating system. Science. 1996. 272: 225-226.
- Takakusaki K., Shiroyama T., Yamamoto T., Kitai S.T. Cholinergic and noncholinergic tegmental pedun-culopontine projection neurons in rats revealed by intracellular labeling. J. Comp. Neurol. 1996. 371: 345-361.
- Brazhnik E.S., Vinogradova O.S., Karanov A.M. Frequency modulation of neuronal theta-bursts in rabbit’s septum by low-frequency repetitive stimulation of the afferent pathways. Neuroscience. 1985. 14: 501-508.
- Klemm W.R. Effects of electric stimulation of brain stem reticular formation on hippocampal theta rhythm and muscle activity in unanesthetized, cervical- and midbrain-transected rats. Brain Res. 1972. 41: 331-344.
- Macadar A.W., Chalupa L.M., Lindsley D.B. Differentiation of brain stem loci which affect hippocampal and neocortical electrical activity. Exp. Neurol. 1974. 43: 499-514.
- McNaughton N., Sedgwick E.M. Reticular stimulation and hippocampal theta rhythm in rats: effects of drugs. Neuroscience. 1978. 3: 629-632.
- Paiva T., Lopes da Silva F.H., Mollevanger W. Modulating systems of hippocampal EEG. Electroen-cephalogr. Clin. Neurophysiol. 1976. 40: 470480.
- Vertes R.P. Brain stem generation of the hippocampal EEG. Prog. Neurobiol. 1982. 19: 159-186.
- Borhegyi Z., Freund T.F. Dual projection from the medial septum to the supramammillary nucleus in the rat. Brain Res. Bull. 1998. 46: 453-459.
- Vertes R.P., McKenna J.T. Collateral projections from the supramammillary nucleus to the medial septum and hippocampus. Synapse. 2000. 38: 281293.
- Vertes R.P. Major diencephalic inputs to the hippocampus: supramammillary nucleus and nucleus reuniens. Circuitry and function. Prog. Brain Res. 2015. 219: 121-144.
- Bland B.H., Konopacki J., Kirk I.J., Oddie S.D., Dickson C.T. Discharge patterns of hippocampal theta-related cells in the caudal diencephalon of the ure-than-anesthetized rat. J. Neurophysiol. 1995. 74: 322-333.
- Kirk I.J., Oddie S.D., Konopacki J., Bland B.H. Evidence for differential control of posterior hypothalamic, supramammillary, and medial mammillary theta-related cellular discharge by ascending and descending pathways. J. Neurosci. 1996. 16: 5547-5554.
- Kirk I.J., McNaughton N. Supramammillary cell firing and hippocampal rhythmical slow activity. Neuroreport. 1991. 2: 723-725.
- Kocsis B., Vertes R.P. Characterization of neurons of the supramammillary nucleus and mammillary body that discharge rhythmically with the hippocampal theta rhythm in the rat. J. Neurosci. 1994. 14: 7040-7052.
- Bland B.H., Oddie S.D., Colom L.V., Vertes R.P. Extrinsic modulation of medial septal cell discharges by the ascending brainstem hippocampal synchronizing pathway. Hippocampus. 1994. 4: 649-660.
- Ariffin M.Z., Low C.M., Khanna S. Medial Septum Modulates Cellular Response Induced in Hippocampus on Microinjection of Cholinergic Agonists into Hypothalamic Lateral Supramammil-lary Nucleus. Front. Neuroanat. 2017. 11: 79.
- Thinschmidt J.S., Kinney G.G., Kocsis B. The suprama-mmillary nucleus: is it necessary for the mediation of hippocampal theta rhythm? Neuroscience. 1995. 67: 301-312.
- Kocsis B., Kaminski M. Dynamic changes in the direction of the theta rhythmic drive between suprama-mmillary nucleus and the septohippocampal system. Hippocampus. 2006. 16: 531-540.
- Assaf S.Y., Miller J.J. The role of a raphe serotonin system in the control of septal unit activity and hippocampal desynchronization. Neuroscience 1978. 3: 539-550.
- McNaughton N., Azmitia E.C., Williams J.H., Buchan A., Gray J.A. Septal elicitation of hippocampal theta rhythm after localized de-afferentation of sero-toninergic fibers. Brain Res. 1980. 200: 259-269.
- Yamamoto T., Watanabe S., Oishi R., Ueki S. Effects of midbrain raphe stimulation and lesion on EEG activity in rats. Brain Res. Bull. 1979. 4: 491—495.
- Maru E., Takahashi L.K., Iwahara S. Effects of median raphe nucleus lesions on hippocampal EEG in the freely moving rat. Brain Res. 1979. 163: 223234.
- Кудина Т.А., Судницын В.В., Кутырева Е.В. Блокатор обратного захвата серотонина флуоксетин подавляет тета-осцилляции в электроэнцефалограмме гиппокампа кролика. Журн. высш. нерв. деят. им. И.П. Павлова. 2003. 53 (5): 651655.
- Kichigina V.F., Gordeeva T.A. [The regulation of the septal pacemaker of theta rhythm by the midbrain raphe nuclei]. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 1995. 45: 848-859.
- Kinney G.G., Kocsis B., Vertes R.P. Medial septal unit firing characteristics following injections of 8-OH-DPAT into the median raphe nucleus. Brain Res. 1996. 708: 116-122.
- Kitchigina V.F., Kudina T.A., Kutyreva E.V., Vinogradova O.S. Neuronal activity of the septal pacemaker of theta rhythm under the influence of stimulation and blockade of the median raphe nucleus in the awake rabbit. Neuroscience. 1999. 94: 453-463.
- Vinogradova O.S., Kitchigina V.F., Kudina T.A., Ze-nchenko K.I. Spontaneous activity and sensory responses of hippocampal neurons during persistent theta-rhythm evoked by median raphe nucleus blockade in rabbit. Neuroscience. 1999. 94: 745753.
- Haghdoost-Yazdi H., Pasbakhsh P., Vatanparast J., Rajaei F., Behzadi G. Topographical and quantitative distribution of the projecting neurons to main divisions of the septal area. Neurol. Res. 2009. 31: 503-513.
- Berridge C.W, Schmeichel B.E., Espana R.A. Noradrenergic modulation of wakefulness/arousal. Sleep Med. Rev. 2012. 16: 187-197.
- McNaughton N., Azmitia E.C., Williams J.H., Buchan A., Gray J.A. Septal elicitation of hippocampal theta rhythm after localized de-afferentation of serotoninergic fibers. Brain Res. 1980. 200: 259-269.
- Robinson T.E., Vanderwolf C.H., Pappas B.A. Are the dorsal noradrenergic bundle projections from the locus coeruleus important for neocortical or hippocampal activation? Brain Res. 1977. 138: 75-98.
- Berridge C.W., Wifler K. Contrasting effects of noradrenergic beta-receptor blockade within the medial septal area on forebrain electroencephalographic and behavioral activity state in anesthetized and unanesthetized rat. Neuroscience. 2000. 97: 543552.
- Kitchigina V.F., Kutyreva E.V., Brazhnik E.S. Modulation of theta rhythmicity in the medial septal neurons and the hippocampal electroencephalogram in the awake rabbit via actions at noradrenergic alpha2-receptors. Neuroscience. 2003. 120: 509521.
- Lisman J., Grace A.A., Duzel E. A neoHebbian framework for episodic memory; role of dopamine-dependent late LTP. Trends Neurosci. 2011. 34: 536-547.
- Miura Y., Ito T., Kadokawa T. Effects of intraseptally injected dopamine and noradrenaline on hippocampal synchronized theta wave activity in rats. Jpn. J. Pharmacol. 1987. 44: 471-479.
- Budek M., Barkai A.I., Brown D.L., Fieve R.R. Suppression of amphetamine-induced EEG arousal in the hippocampus of haloperidol-treated rabbits. Neuropsychobiology 1981. 7: 99-104.
- Кичигина В.Ф. Дофаминергическая регуляция тета-активности септо-гиппокампальных нейронов у бодрствующих кроликов. Журн. высш. нерв. деят. им. И.П. Павлова. 2004. 54 (2): 210-215.
- Nakagawa T., Ukai K., Ohyama T., Gomita Y., Okamu-ra H. Effect of dopaminergic drugs on the reserpine-induced lowering of hippocampal theta wave frequency in rats. Nihon Shinkei Seishin Yak-urigaku Zasshi. 2000. 20: 71-76.
- Силькис И.Г. Механизмы влияния дофамина через базальные ганглии на септо-гиппокампальный тета-ритм. Нейрохимия. 2008. 25: 184-190.
- Geisler S., Zahm D.S. Afferents of the ventral tegmental area in the rat-anatomical substratum for integrative functions. J. Comp. Neurol. 2005. 490: 270-294.
- Inglis W.L., Winn P. The pedunculopontine tegmental nucleus: where the striatum meets the reticular formation. Prog. Neurobiol. 1995. 47: 1-29.
- Orzet-Gryglewska J., Matulewicz P., Jurkowlaniec E. Brainstem system of hippocampal theta induction: The role of the ventral tegmental area. Synapse. 2015. 69: 553-575.
- Kramis R., Vanderwolf C.H., Bland B.H. Two types of hippocampal rhythmical slow activity in both the rabbit and the rat: relations to behavior and effects of atropine, diethyl ether, urethane, and pentobarbital. Exp. Neurol. 1975. 49: 58-85.
- Stewart M., Fox S.E. Detection of an atropine-resistant component of the hippocampal theta rhythm in urethane-anesthetized rats. Brain Res. 1989. 500: 55-60.
- Ylinen A., Soltesz I., Bragin A., Penttonen M., Sik A., Buzsaki G. Intracellular correlates of hippocampal theta rhythm in identified pyramidal cells, granule cells, and basket cells. Hippocampus. 1995. 5: 78— 90.
- Fuhrmann F., Justus D., Sosulina L., Kaneko H., Beutel T., Friedrichs D., Schoch S., Schwarz M.K., Fuhrmann M., Remy S. Locomotion, Theta Oscillations, and the Speed-Correlated Firing of Hippocampal Neurons Are Controlled by a Medial Septal Glutamatergic Circuit. Neuron. 2015. 86: 1253-1264.
- Justus D., Dalugge D., Bothe S., Fuhrmann F., Hannes C., Kaneko H., Friedrichs D., Sosulina L., Schwarz I., Elliott D.A., Schoch S., Bradke F., Schwarz M.K., Remy S. Glutamatergic synaptic integration of locomotion speed via septoentorhinal projections. Nat. Neurosci. 2017. 20: 16-19.
- Zhou T.L., Tamura R., Kuriwaki J., Ono T. Comparison of medial and lateral septal neuron activity during performance of spatial tasks in rats. Hippocampus. 1999. 9: 220-234.
- Tsanov M. Speed and oscillations: medial septum integration of attention and navigation. Front. Syst. Neurosci. 2017. 11: 67.
- Cabral H.O., Vinck M., Fouquet C., Pennartz CMA Rondi-Reig L., Battaglia F.P. Oscillatory dynamics and place field maps reflect hippocampal ensemble processing of sequence and place memory under NMDA receptor control. Neuron. 2014. 81: 402-415.
- Colgin L.L. Mechanisms and functions of theta rhythms. Annu. Rev. Neurosci. 2013. 36: 295-312.
- Fernandez-Ruiz A., Makarov V.A., Benito N., Herreras O. Schaffer-specific local field potentials reflect discrete excitatory events at gamma frequency that may fire postsynaptic hippocampal CA1 units. J. Neurosci. 2012. 32: 5165-5176.
- Fernandez-Ruiz A., Oliva A., Nagy G.A., Maurer A.P., Berenyi A., Buzsaki G. Entorhinal-CA3 Dual-Input Control of Spike Timing in the Hippocampus by Theta-Gamma Coupling. Neuron. 2017. 93: 1213-1226.e5.
- Montgomery S.M., Sirota A., Buzsaki G. Theta and gamma coordination of hippocampal networks during waking and rapid eye movement sleep. J. Neurosci. 2008. 28: 6731-6741.
- Schomburg E.W., Fernandez-Ruiz A., Mizuseki K., Berenyi A., Anastassiou C.A., Koch C., Buzsaki G. Theta phase segregation of input-specific gamma patterns in entorhinal-hippocampal networks. Neuron. 2014. 84: 470-485.
- Bland B.H., Anderson P., Ganes T. Two generators of hippocampal theta activity in rabbits. Brain Res. 1975. 94: 199-218.
- Buzsaki G., Leung L.W., Vanderwolf C.H. Cellular bases of hippocampal EEG in the behaving rat. Brain Res. 1983. 287: 139-171.
- Fox S.E., Wolfson S., Ranck J.B. Hippocampal theta rhythm and the firing of neurons in walking and urethane anesthetized rats. Exp. Brain Res. 1986. 62: 495-508.
- Mizuseki K., Sirota A., Pastalkova E., Buzsaki G. Theta oscillations provide temporal windows for local circuit computation in the entorhinal-hippocam-pal loop. Neuron. 2009. 64: 267-280.
- Brankack J., Stewart M., Fox S.E. Current source density analysis of the hippocampal theta rhythm: associated sustained potentials and candidate synaptic generators. Brain Res. 1993. 615: 310-327.
- Buzsaki G., Czopf J., KondakorI., Kellenyi L. Laminar distribution of hippocampal rhythmic slow activity (RSA) in the behaving rat: current-source density analysis, effects of urethane and atropine. Brain Res. 1986. 365: 125-137.
- Steward O. Topographic organization of the projections from the entorhinal area to the hippocampal formation of the rat. J. Comp. Neurol. 1976. 167: 285-314.
- Amaral D.G., Witter M.P. The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience. 1989. 31: 571591.
- Steward O., Scoville S.A. Cells of origin of entorhinal cortical afferents to the hippocampus and fascia dentata of the rat. J. Comp. Neurol. 1976. 169: 347-370.
- Gonzalez-Sulser A., Parthier D., Candela A., McClure C., Pastoll H., Garden D., Surmeli G., Nolan M.F. GABAergic projections from the medial septum selectively inhibit interneurons in the medial entorhinal cortex. J. Neurosci. 2014. 34: 16739-16743.
- Alonso A., Gartfa-Austt E. Neuronal sources of theta rhythm in the entorhinal cortex of the rat. I. Laminar distribution of theta field potentials. Exp. Brain Res. 1987. 67: 493-501.
- Mitchell S.J., Ranck J.B. Generation of theta rhythm in medial entorhinal cortex of freely moving rats. Brain Res. 1980. 189: 49-66.
- Mizuseki K., Sirota A., Pastalkova E., Buzsaki G. Theta oscillations provide temporal windows for local circuit computation in the entorhinal-hippocampal loop. Neuron. 2009. 64: 267-280.
- Stewart M., Quirk G.J., Barry M., Fox S.E. Firing relations of medial entorhinal neurons to the hippocampal theta rhythm in urethane anesthetized and walking rats. Exp. Brain Res. 1992. 90: 21-28.
- Kamondi A., Acsady L., Wang X.J., Buzsaki G. Theta oscillations in somata and dendrites of hippocampal pyramidal cells in vivo: activity-dependent phase-precession of action potentials. Hippocampus. 1998. 8: 244-261.
- Mizuseki K., Sirota A., Pastalkova E., Buzsaki G. Theta oscillations provide temporal windows for local circuit computation in the entorhinal-hippocampal loop. Neuron. 2009. 64: 267-280.
- Buzsaki G. Hippocampal sharp wave-ripple: A cognitive biomarker for episodic memory and planning. Hippocampus 2015. 25: 1073-1188.
- Colgin L.L. Theta-gamma coupling in the entorhinal-hippocampal system. Curr. Opin. Neurobiol. 2015. 31: 45-50.
- Colgin L.L., Moser E.I. Gamma oscillations in the hippocampus. Physiology (Bethesda). 2010. 25: 319329.
- Einevoll G.T., Kayser C., Logothetis N.K., Panzeri S. Modelling and analysis of local field potentials for studying the function of cortical circuits. Nat. Rev. Neurosci. 2013. 14: 770-785.
- Buzsaki G., Anastassiou C.A., Koch C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nat. Rev. Neurosci. 2012. 13: 407-420.
- Csicsvari J., Hirase H., Czurko A., Buzsaki G. Reliability and state dependence of pyramidal cell-interneuron synapses in the hippocampus: an ensemble approach in the behaving rat. Neuron. 1998. 21: 179-189.
- Schomburg E.W., Anastassiou C.A., Buzsaki G., Koch C. The spiking component of oscillatory extracellular potentials in the rat hippocampus. J. Neurosci. 2012. 32: 11798-11811.
- Freund T.F., Buzsaki G. Interneurons of the hippocampus. Hippocampus. 1996. 6: 347-470.
- Klausberger T., Magill PJ., Marton L.F, Roberts J.D.B., Cobden P.M., Buzsaki G., Somogyi P Brain-state-and cell-type-specific firing of hippocampal interneurons in vivo. Nature. 2003. 421: 844-848.
- Somogyi P., Klausberger T. Defined types of cortical interneuron structure space and spike timing in the hippocampus. J. Physiol. (Lond). 2005. 562: 9-26.
- Varga C., Golshani P., Soltesz I. Frequency-invariant temporal ordering of interneuronal discharges during hippocampal oscillations in awake mice. Proc. Natl. Acad. Sci. U. S. A. 2012. 109: E2726-34.
- Einevoll G.T., Kayser C., Logothetis N.K., Panzeri S. Modelling and analysis of local field potentials for studying the function of cortical circuits. Nat. Rev. Neurosci. 2013. 14: 770-785.
- Ylinen A., Soltesz I., Bragin A., Penttonen M., Sik A., Buzsaki G. Intracellular correlates of hippocampal theta rhythm in identified pyramidal cells, granule cells, and basket cells. Hippocampus. 1995. 5: 78— 90.
- Royer S., Zemelman B.V., Losonczy A., Kim J., Chance F., Magee J.C., Buzsaki G. Control of timing, rate and bursts of hippocampal place cells by dendritic and somatic inhibition. Nat. Neurosci. 2012. 15: 769775.
- Amilhon B., Huh C.Y.L., Manseau F., Ducharme G., Nichol H., Adamantidis A., Williams S. Parvalbu-min interneurons of hippocampus tune population activity at theta frequency. Neuron. 2015. 86: 1277-1289.
- Klausberger T., Magill PJ., Marton L.F, Roberts J.D.B., Cobden P.M., Buzsaki G., Somogyi P Brain-state-and cell-type-specific firing of hippocampal interneurons in vivo. Nature. 2003. 421: 844-848.
- Amilhon B., Huh C.Y.L., Manseau F., Ducharme G., Nichol H., Adamantidis A., Williams S. Parvalbu-min interneurons of hippocampus tune population activity at theta frequency. Neuron. 2015. 86: 1277-1289.
- Somogyi P., Katona L., Klausberger T., Lasztoczi B., Viney T.J. Temporal redistribution of inhibition over neuronal subcellular domains underlies statedependent rhythmic change of excitability in the hippocampus. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2014. 369: 20120518.
- Soltesz I., Deschenes M. Low- and high-frequency membrane potential oscillations during theta activity in CA1 and CA3 pyramidal neurons of the rat hippocampus under ketamine-xylazine anesthesia. J. Neurophysiol. 1993. 70: 97-116.
- Hayman L.A., Fuller G.N., Cavazos J.E., Pfleger M.J., Meyers C.A., Jackson E.F. The hippocampus: normal anatomy and pathology. AJR Am. J. Roentgenol. 1998. 171: 1139-1146.
- Montgomery S.M., Betancur M.I., Buzsaki G. Behavior-dependent coordination of multiple theta dipoles in the hippocampus. J. Neurosci. 2009. 29: 1381-1394.
- Kocsis B., Bragin A., Buzsaki G. Interdependence of multiple theta generators in the hippocampus: a partial coherence analysis. J. Neurosci. 1999. 19: 6200-6212.
- Colgin L.L. Theta-gamma coupling in the entorhinal-hippocampal system. Curr. Opin. Neurobiol. 2015. 31: 45-50.
- Hernandez-Perez J.J., Gutierrez-Guzman B.E., Olvera-Cortes M.E. Hippocampal strata theta oscillations change their frequency and coupling during spatial learning. Neuroscience. 2016. 337: 224-241.
- Mizuseki K., Sirota A., Pastalkova E., Buzsaki G. Theta oscillations provide temporal windows for local circuit computation in the entorhinal-hippocampal loop. Neuron. 2009. 64: 267-280.
- Montgomery S.M., Betancur M.I., Buzsaki G. Behavior-dependent coordination of multiple theta dipoles in the hippocampus. J. Neurosci. 2009. 29: 1381-1394.
- Sabolek H.R., Penley S.C., Hinman J.R., Bunce J.G., Markus E.J., Escabi M., Chrobak J.J. Theta and gamma coherence along the septotemporal axis of the hippocampus. J. Neurophysiol. 2009. 101: 1192-1200.
- Soltesz I., Deschenes M. Low- and high-frequency membrane potential oscillations during theta activity in CA1 and CA3 pyramidal neurons of the rat hippocampus under ketamine-xylazine anesthesia. J. Neurophysiol. 1993. 70: 97-116.
- Somogyi P., Katona L., Klausberger T., Lasztoczi B., Viney T.J. Temporal redistribution of inhibition over neuronal subcellular domains underlies statedependent rhythmic change of excitability in the hippocampus. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2014. 369: 20120518.
- Barnes C.A. Effects of aging on the dynamics of information processing and synaptic weight changes in the mammalian hippocampus. Prog. Brain Res. 1990. 86: 89-104.
- Buzsaki G., Bickford R.G., Ryan L.J., Young S., Pro-haska O., Mandel R.J., Gage F.H. Multisite recording of brain field potentials and unit activity in freely moving rats. J. Neurosci. Methods 1989. 28: 209-217.
- Strata F. Intrinsic oscillations in CA3 hippocampal pyramids: physiological relevance to theta rhythm generation. Hippocampus. 1998. 8: 666-679.
- Unal G., Joshi A., Viney T.J., Kis V., Somogyi P. Synaptic targets of medial septal projections in the hippocampus and extrahippocampal cortices of the mouse. J. Neurosci. 2015. 35: 15812-15826.
- Chater T.E., Goda Y. CA3 mossy fiber connections: giant synapses that gain control. Neuron. 2013. 77: 4-6.
- Szabadics J., Soltesz I. Functional specificity of mossy fiber innervation of GABAergic cells in the hippocampus. J. Neurosci. 2009. 29: 4239-4251.
- Jackson J., Amilhon B., Goutagny R., Bott J.-B., Man-seau F., Kortleven C., Bressler S.L., Williams S. Reversal of theta rhythm flow through intact hippocampal circuits. Nat. Neurosci. 2014. 17: 13621370.
- Soltesz I., Deschenes M. Low- and high-frequency membrane potential oscillations during theta activity in CA1 and CA3 pyramidal neurons of the rat hippocampus under ketamine-xylazine anesthesia. J. Neurophysiol. 1993. 70: 97-116.
- Witter M.P. The perforant path: projections from the entorhinal cortex to the dentate gyrus In The Dentate Gyrus. Progress in brain research. 2007. (163): 43-61.
- Leranth C., Hajszan T. Extrinsic afferent systems to the dentate gyrus. Progress in Brain Research. 2007. 799 (163): 63-84.
- Nyakas C., Luiten P.G., Spencer D.G., Traber J. Detailed projection patterns of septal and diagonal band efferents to the hippocampus in the rat with emphasis on innervation of CA1 and dentate gyrus. Brain Res. Bull. 1987. 18: 533-545.
- Greenstein Y.J., Pavlides C., Winson J. Long-term potentiation in the dentate gyrus is preferentially induced at theta rhythm periodicity. Brain Res. 1988. 438: 331-334.
- Orr G., Rao G., Houston F.P., McNaughton B.L., Barnes C.A. Hippocampal synaptic plasticity is modulated by theta rhythm in the fascia dentata of adult and aged freely behaving rats. Hippocampus. 2001. 11: 647-654.
- Pavlides C., Greenstein Y.J., Grudman M., Winson J. Long-term potentiation in the dentate gyrus is induced preferentially on the positive phase of thetarhythm. Brain Res. 1988. 439: 383-387.
- Kerr K.M., Agster K.L., Furtak S.C., Burwell R.D. Functional neuroanatomy of the parahippocampal region: the lateral and medial entorhinal areas. Hippocampus. 2007. 17: 697—708.
- Gonzalez-Sulser A., Parthier D., Candela A., McClure C., Pastoll H., Garden D., Surmeli G., Nolan M.F. GABAergic projections from the medial septum selectively inhibit interneurons in the medial ento-rhinal cortex. J. Neurosci. 2014. 34: 16739-16743.
- Quilichini P., Sirota A., Buzsaki G. Intrinsic circuit organization and theta-gamma oscillation dynamics in the entorhinal cortex of the rat. J. Neurosci. 2010. 30: 11128-11142.
- Hafting T., Fyhn M., Molden S., Moser M.B., Moser E.I. Microstructure of a spatial map in the entorhinal cortex. Nature. 2005. 436: 801-806.
- Ray S., Naumann R., Burgalossi A., Tang Q., Schmidt H., Brecht M. Grid-layout and theta-modulation of layer 2 pyramidal neurons in medial entorhinal cortex. Science. 2014. 343: 891-896.
- Jeewajee A., Barry C., Douchamps V., Manson D., Lever C., Burgess N. Theta phase precession of grid and place cell firing in open environments. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2014. 369: 20120532.
- Pastoll H., Solanka L., van Rossum M.C., Nolan M.F. Feedback inhibition enables О-nested у oscillations and grid firing fields. Neuron. 2013. 77: 141154.
- Konopacki J., Bland B.H., MacIver M.B., Roth S.H. Cholinergic theta rhythm in transected hippocampal slices: independent CA1 and dentate generators. Brain Res. 1987. 436: 217-222.
- Fellous J.M., Sejnowski T.J. Cholinergic induction of oscillations in the hippocampal slice in the slow (0.5-2 Hz), theta (5-12 Hz), and gamma (3570 Hz) bands. Hippocampus. 2000. 10 (2): 187197.
- Fisahn A., Yamada M., DuttaroyA., Gan J-W, DengC.-X., McBain C.J., Wess J. Muscarinic induction of hippocampal gamma oscillations requires coupling of the M1 receptor to two mixed cation currents. Neuron. 2002. 33: 615-624.
- Gillies M.J., Traub R.D., LeBeau F.E.N., Davies C.H., Gloveli T., Buhl E.H., Whittington M.A. A model of atropine-resistant theta oscillations in rat hippocampal area CA1. J. Physiol. (Lond). 2002. 543: 779-793.
- Kazmierska P., Konopacki J. Development of NMDA-induced theta rhythm in hippocampal formation slices. Brain Res. Bull. 2013. 98: 93-101.
- Kowalczyk T., Bocian R., Konopacki J. The generation of theta rhythm in hippocampal formation maintained in vitro. Eur. J. Neurosci. 2013. 37: 679699.
- Williams J.H., Kauer J.A. Properties of carbachol-in-duced oscillatory activity in rat hippocampus. J. Neurophysiol. 1997. 78: 2631-2640.
- Fellous J.M., Sejnowski T.J. Cholinergic induction of oscillations in the hippocampal slice in the slow (0.5-2 Hz), theta (5-12 Hz), and gamma (3570 Hz) bands. Hippocampus. 2000. 10 (2): 187197.
- Fisahn A., Yamada M., DuttaroyA., Gan J-W, DengC.-X., McBain C.J., Wess J. Muscarinic induction of hippocampal gamma oscillations requires coupling of the M1 receptor to two mixed cation currents. Neuron. 2002. 33: 615-624.
- Gillies M.J., Traub R.D., LeBeau F.E.N., Davies C.H., Gloveli T., Buhl E.H., Whittington M.A. A model of atropine-resistant theta oscillations in rat hippocampal area CA1. J. Physiol. (Lond). 2002. 543: 779-793.
- Kazmierska P., Konopacki J. Development of NMDA-induced theta rhythm in hippocampal formation slices. Brain Res. Bull. 2013. 98: 93-101.
- Kowalczyk T., Bocian R., Konopacki J. The generation of theta rhythm in hippocampal formation maintained in vitro. Eur. J. Neurosci. 2013. 37: 679699.
- Toth K., Freund T.F., Miles R. Disinhibition of rat hippocampal pyramidal cells by GABAergic afferents from the septum. J. Physiol. (Lond). 1997 (Pt 2). 500: 463-474.
- Williams J.H., Kauer J.A. Properties of carbachol-in-duced oscillatory activity in rat hippocampus. J. Neurophysiol. 1997. 78: 2631-2640.
- Ylinen A., Soltesz I., Bragin A., Penttonen M., Sik A., Buzsaki G. Intracellular correlates of hippocampal theta rhythm in identified pyramidal cells, granule cells, and basket cells. Hippocampus. 1995. 5: 78— 90.
- Mizuseki K., Buzsaki G. Theta oscillations decrease spike synchrony in the hippocampus and entorhi-nal cortex. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2014. 369: 20120530.
- Borisyuk R. Oscillatory activity in the neural networks of spiking elements. BioSystems. 2002. 67: 3-16.
- Hopfield J.J., Herz A.V. Rapid local synchronization of action potentials: toward computation with coupled integrate-and-fire neurons. Proc. Natl. Acad. Sci. U. S. A. 1995. 92: 6655-6662.
- Kudela P., Franaszczuk P.J., Bergey G.K. Changing excitation and inhibition in simulated neural networks: effects on induced bursting behavior. Biol. Cybern. 2003. 88: 276-285.
- Bezaire M.J., Raikov I., Burk K., Vyas D., Soltesz I. Interneuronal mechanisms of hippocampal theta oscillations in a full-scale model of the rodent CA1 circuit. elife 2016. 5: e18566.
- Orban G., Kiss T., Erdi P. Intrinsic and synaptic mechanisms determining the timing of neuron population activity during hippocampal theta oscillation. J. Neurophysiol. 2006. 96: 2889-2904.
- Rotstein H.G., Pervouchine D.D., Acker C.D., Gillies M.J., White J.A., Buhl E.H., Whittington M.A., Kopell N. Slow and fast inhibition and an H-current interact to create a theta rhythm in a model of CA1 interneuron network. J. Neurophysiol. 2005. 94: 15091518.
- Colgin L.L. Rhythms of the hippocampal network. Nat. Rev. Neurosci. 2016. 17: 239-249.
- Colgin L.L. Theta-gamma coupling in the entorhinal-hippocampal system. Curr. Opin. Neurobiol. 2015. 31: 45-50.
- Colgin L.L., Moser E.I. Gamma oscillations in the hippocampus. Physiology (Bethesda). 2010. 25: 319329.
- Belluscio M.A., Mizuseki K., Schmidt R., Kempter R., Buzsaki G. Cross-frequency phase-phase coupling between 0 and y oscillations in the hippocampus. J. Neurosci. 2012. 32: 423-435.
- Buzsaki G., Wang X. Mechanisms of gamma oscillations. Annu. Rev. Neurosci. 2012. 35: 203-225.
- Carr M.F., Karlsson M.P., Frank L.M. Transient slow gamma synchrony underlies hippocampal memory replay. Neuron. 2012. 75: 700-713.
- Colgin L.L., Denninger T., Fyhn M., Hafting T., Bonne-vie T., Jensen O., Moser M.B., Moser E.I. Frequency of gamma oscillations routes flow of information in the hippocampus. Nature. 2009. 462: 353357.
- Colgin L.L. Slow gamma takes the reins in replay. Neuron. 2012. 75: 549-550.
- Kemere C., Carr M.F., Karlsson M.P., Frank L.M. Rapid and continuous modulation of hippocampal network state during exploration of new places. PLoS ONE. 2013. 8: e73114.
- Takahashi M., Nishida H., Redish A.D., Lauwereyns J. Theta phase shift in spike timing and modulation of gamma oscillation: a dynamic code for spatial alternation during fixation in rat hippocampal area CA1. J. Neurophysiol. 2014. 111: 1601-1614.
- Chen Z., Resnik E., McFarland J.M., Sakmann B., Mehta M.R. Speed controls the amplitude and timing of the hippocampal gamma rhythm. PLoS ONE. 2011. 6: e21408.
- Nishida H., Takahashi M., Lauwereyns J. Within-ses-sion dynamics of theta-gamma coupling and high-frequency oscillations during spatial alternation in rat hippocampal area CA1. Cogn. Neurodyn. 2014. 8: 363-372.
- Pfeiffer B.E. The content of hippocampal “replay”. Hippocampus. 2020. 30 (1): 6-18.
- Pfeiffer B.E., Foster D.J. Place cells. Autoassociative dynamics in the generation of sequences of hippocampal place cells. Science. 2015. 349: 180-183.
- Wu C-T., Haggerty D., Kemere C., J.i., D. Hippocampal awake replay in fear memory retrieval. Nat. Neurosci. 2017. 20: 571-580.
- Blasco-Ibanez J.M., Freund T.F. Synaptic input of horizontal interneurons in stratum oriens of the hippocampal CA1 subfield: structural basis of feedback activation. Eur. J. Neurosci. 1995. 7: 21702180.
- Mattis J., Brill J., Evans S., Lerner T.N., Davidson T.J., Hyun M., Ramakrishnan C., Deisseroth K., Hugue-nard J.R. Frequency-dependent, cell type-divergent signaling in the hippocamposeptal projection. J. Neurosci. 2014. 34: 11769-11780.
- Dragoi G., Carpi D., Recce M., Csicsvari J., Buzsaki G. Interactions between hippocampus and medial septum during sharp waves and theta oscillation in the behaving rat. J. Neurosci. 1999. 19: 6191-6199.
- Buzsaki G. Hippocampal sharp wave-ripple: A cognitive biomarker for episodic memory and planning. Hippocampus 2015. 25: 1073-1188.
- Lubenov E.V., Siapas A.G. Hippocampal theta oscillations are travelling waves. Nature. 2009. 459: 534539.
- Long L.L., Bunce J.G., Chrobak J.J. Theta variation and spatiotemporal scaling along the septotempo-ral axis of the hippocampus. Front. Syst. Neuros-ci. 2015. 9: 37.
- Patel J., Fujisawa S., Berenyi A., Royer S., Buzsaki G. Traveling theta waves along the entire septotempo-ral axis of the hippocampus. Neuron. 2012. 75: 410-417.
- Zhang H., Jacobs J. Traveling theta waves in the human hippocampus. J. Neurosci. 2015. 35: 12477— 12487.
- Benucci A., Frazor R.A., Carandini M. Standing waves and traveling waves distinguish two circuits in visual cortex. Neuron. 2007. 55: 103-117.
- Penley S.C., Hinman J.R., Sabolek H.R., Escabi M.A., Markus E.J., Chrobak J.J. Theta and gamma coherence across the septotemporal axis during distinct behavioral states. Hippocampus. 2012. 22: 1164-1175.
- Sabolek H.R., Penley S.C., Hinman J.R., Bunce J.G., Markus E.J., Escabi M., Chrobak J.J. Theta and gamma coherence along the septotemporal axis of the hippocampus. J. Neurophysiol. 2009. 101: 1192-1200.
- Hinman J.R., Penley S.C., Long L.L., Escabi M.A., Chrobak J.J. Septotemporal variation in dynamics of theta: speed and habituation. J. Neurophysiol. 2011. 105: 2675-2686.
- Long L.L., Hinman J.R., Chen C.-M., Escabi M.A., Chrobak J.J. Theta dynamics in rat: speed and acceleration across the Septotemporal axis. PLoS ONE. 2014. 9: e97987.
- Jung M.W., Wiener S.I., McNaughton B.L. Comparison of spatial firing characteristics of units in dorsal and ventral hippocampus of the rat. J. Neurosci. 1994. 14: 7347-7356.
- Kjelstrup K.B., Solstad T., Brun V.H., Hafting T., Leut-geb S., Witter M.P., Moser E.I., Moser M.-B. Finite scale of spatial representation in the hippocampus. Science. 2008. 321: 140-143.
- Long L.L., Bunce J.G., Chrobak J.J. Theta variation and spatiotemporal scaling along the septotemporal axis of the hippocampus. Front. Syst. Neurosci. 2015. 9: 37.
- Strange B.A., Witter M.P., Lein E.S., Moser E.I. Functional organization of the hippocampal longitudinal axis. Nat. Rev. Neurosci. 2014. 15: 655-669.
- Lubenov E.V., Siapas A.G. Hippocampal theta oscillations are travelling waves. Nature. 2009. 459: 534539.
- Patel J., Fujisawa S., Berenyi A., Royer S., Buzsaki G. Traveling theta waves along the entire septotemporal axis of the hippocampus. Neuron. 2012. 75: 410-417.
- Zhang H., Jacobs J. Traveling theta waves in the human hippocampus. J. Neurosci. 2015. 35: 12477— 12487.
- Miles R., Traub R.D., Wong R.K. Spread of synchronous firing in longitudinal slices from the CA3 region of the hippocampus. J. Neurophysiol. 1988. 60: 1481-1496.
- Maurer A.P., Vanrhoads S.R., Sutherland G.R., Lipa P., McNaughton B.L. Self-motion and the origin of differential spatial scaling along the septo-tempo-ral axis of the hippocampus. Hippocampus. 2005. 15: 841-852.
- Buzsaki G. Theta oscillations in the hippocampus. Neuron 2002. 33: 325-340.
- Unal G., Joshi A., Viney T.J., Kis V., Somogyi P. Synaptic targets of medial septal projections in the hippocampus and extrahippocampal cortices of the mouse. J. Neurosci. 2015. 35: 15812-15826.
- Vertes R.P., Hoover W.B., Viana D.i., Prisco G. Theta rhythm of the hippocampus: subcortical control and functional significance. Behav. Cogn. Neurosci. Rev. 2004. 3: 173-200.
- Vinogradova O.S. Expression, control, and probable functional significance of the neuronal thetarhythm. Prog. Neurobiol. 1995. 45: 523-583.
- Kitchigina V.F., Kudina T.A., Kutyreva E.V., Vinogradova O.S. Neuronal activity of the septal pacemaker of theta rhythm under the influence of stimulation and blockade of the median raphe nucleus in the awake rabbit. Neuroscience. 1999. 94: 453-463.
- Kitchigina V.F., Kutyreva E.V., Brazhnik E.S. Modulation of theta rhythmicity in the medial septal neurons and the hippocampal electroencephalogram in the awake rabbit via actions at noradrenergic al-pha2-receptors. Neuroscience. 2003. 120: 509521.
- Vertes R.P., Kocsis B. Brainstem-diencephalo-septo-hippocampal systems controlling the theta rhythm of the hippocampus. Neuroscience. 1997. 81: 893-926.
- Vinogradova O.S., Kitchigina V.F., Kudina T.A., Ze-nchenko K.I. Spontaneous activity and sensory responses of hippocampal neurons during persistent theta-rhythm evoked by median raphe nucleus blockade in rabbit. Neuroscience. 1999. 94: 745753.
- Colgin L.L. Mechanisms and functions of theta rhythms. Annu. Rev. Neurosci. 2013. 36: 295-312.
- Dragoi G., Buzsaki G. Temporal encoding of place sequences by hippocampal cell assemblies. Neuron. 2006. 50: 145-157.
- Wang Y., Romani S., Lustig B., Leonardo A., Pastalkova E. Theta sequences are essential for internally generated hippocampal firing fields. Nat. Neurosci. 2015. 18: 282-288.
- Wojtowicz T., Mozrzymas J.W. Diverse impact of neuronal activity at 0 frequency on hippocampal longterm plasticity. J. Neurosci. Res. 2015. 93: 13301344.