Биоэлектрическая активность мозга (БЭА) — это электрическая активность нейронов, связанная с их возбуждением, т.е. со сдвигом мембранного потенциала.
В основе биоэлектрической активности головного мозга лежат трансмембранные ионные токи, которые порождают явления потенциала действия и импульсной активности нейронов. Таким образом осуществляется нейронная передача сигналов в виде коротких электрических импульсов, каждый из которых представляет собой основную информационную единицу мозга (квант информации).12
Механизм
Биоэлектрическая активность мозга объясняется физиологией нервной ткани. Каждый нейрон покрыт мембраной. Встроенные в мембрану белковые насосы создают разницу электрических потенциалов внутри и снаружи клетки за счет нагнетания заряженных ионов натрия, калия, хлора и др.
Возбуждение нейрона связано с открытием ионных каналов и прохождением ионов через мембрану, что приводит к изменению напряжения, которое и регистрируется различными методами в виде биоэлектрической активности.
Отдельно взятый нейрон находится в непрерывном процессе биоэлектрогенеза. Возбуждение нервной клетки может происходить при ее раздражении, т.е. при поступлении импульса от других нейронов, а в некоторых случаях — спонтанно. Других источников биоэлектрического поля, кроме нейронов, в головном мозге нет.
➥ Основная статья: Биоэлектрические потенциалы
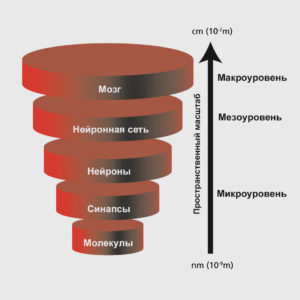
Уровни организации головного мозга
Условно выделяют три уровня организации головного мозга, на которых можно исследовать разные формы биоэлектрической активности: микроуровень (активность одного нейрона), мезоуровень (активность локальной группы нейронов) и макроуровень (активность разных областей мозга).
➥ Более подробно: Функциональные системы, структура и организация мозга
Микроуровень (англ. microscale) – самый низший уровень организации головного мозга, отражающий активность одиночных нейронов за счет синаптических и молекулярных механизмов.
Мезоуровень (англ. mesoscale) – уровень, находящийся между микро- и макроуровнем, на котором происходит взаимодействия между крупными нейронными ансамблями.
Макроуровень (англ. macroscale) – используется для определения областей мозга и крупномасштабных связей между ними.
Методы регистрации биоэлектрической активности головного мозга
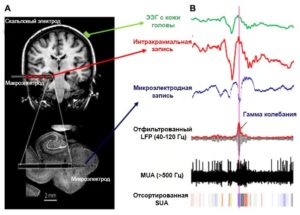
Изучение биоэлектрической активности проводится при помощи электрофизиологических методов, основанных на регистрации колебания разности потенциалов между двумя точками среды, например между двумя электродами, расположенных на коже головы.
Электроэнцефалография (ЭЭГ, англ. electroencephalography, EEG) – неинвазивный метод, позволяющий регистрировать биоэлектрическую активность мозга с поверхности скальпа черепа.
➥ Основная статья: Электроэнцефалография
Магнитоэнцефалография (МЭГ, англ. magnetoencephalography, MEG ) – метод, основанный на регистрации магнитного поля, которое формируется за счет электрической активности нейронов.
Электрокортикография (ЭКоГ, англ. electrocorticography, ECoG) – инвазивный метод регистрации биоэлектрической активности при помощи электродов, расположенных на поверхности коры головного мозга.
➥ Основная статья: Электрокортикография
Микроэлектродные методы – совокупность методов, использующих микроэлектроды для внутри- либо внеклеточной регистрации биопотенциалов. К ним можно отнести регистрацию активности одиночного нейрона, мультиюнитной активности, потенциала локального поля (LFP), а также patch clamp и dynamic clamp методы.
➥ Читайте также: Микроэлектродный метод измерения мембранного потенциала
Виды биоэлектрической активности
Биоэлектрическая активность в зависимости от масштаба (от одного нейрона до скоординированной деятельности крупных нейронных ансамблей) проявляется в разных формах.
➥ Основная статья: Функциональные системы, структура и организация мозга
| Микроуровень мозга | Мезоуровень мозга | Макроуровень мозга | |
|---|---|---|---|
| Регулярная биоэлектрическая активность | Пачки спайков (англ. spike trains); Регулярный паттерн подпороговых колебаний мембранного потенциала (англ. regular pattern of subthreshold membrane potential oscillations, SMPO) | Осцилляции нейронных популяций | Мозговые ритмы или волны, порождаемые самыми крупными нейронными ансамблями |
| Нерегулярная биоэлектрическая активность | Тепловой шум (англ. thermal noise); Канальный шум (англ. channel noise); Берстовый шум (англ. burst noise); Синаптический шум (англ. synaptic noise); Cпайк (англ. spike) | 1/f шум | Дезорганизованная ЭЭГ 1/f шум |
| Транзиентная биоэлектрическая активность | Нерегулярные подпороговые колебания мембранного потенциала (англ. irregular subthreshold membrane potential oscillations); Веретенообразные подпороговые колебания мембранного потенциала (англ. spindle-like subthreshold membrane potential oscillations) | Неэпилептиформная транзиентная активность (SWR); Эпилептиформная транзиентная активность (межиктальная эпилептиформная активность, IED) | Неэпилептиформная (англ. nonepileptiform) транзиентная активность; Эпилептиформная транзиентная активность (англ. epileptiform discharges); Потенциал, связанный с событием (англ. event-related potential, ERP) |
Ритмическая активность
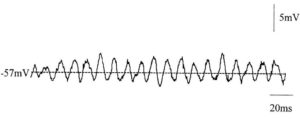
➥ Основная статья: Ритмическая активность головного мозга
Ритмическая или регулярная биоэлектрическая активность – это повторяющиеся частотные паттерны в центральной нервной системе. Иными словами, это однотипные или самоподобные колебательные события, которые повторяются с одинаковыми интервалами.
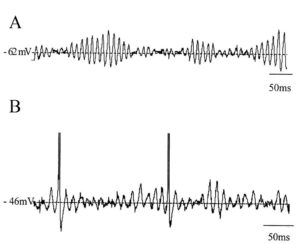
Нейронные колебания, порождаемые биоэлектрической активностью головного мозга, наблюдаются во всей центральной нервной системе на всех уровнях ее организации и включают в себя пачки спайков (spike trains/bursting), регулярный паттерн подпороговых колебаний мембранного потенциала, высокоамплитудные колебания потенциала локального поля и крупномасштабные колебания (мозговые волны).
ЭЭГ является одним из самых доступных электрофизиологических методов регистрации ритмической активности. Так как электрическое поле, создаваемое одиночным нейроном или совокупностью близкорасположенных нейронов, настолько мало, что не может быть зарегистрировано с поверхности головы, ЭЭГ – это метод, который отражает суммарную активность большого пула нейронов, величина которого достаточна для формирования разницы потенциала на поверхности скальпа. Следует подчеркнуть, что электрическая активность должна быть настолько большой мощности, насколько это потребуется для прохождения сигнала через кости черепа и кожные покровы, обладающие заметным сопротивлением электрическому току. Опять-таки, исходя из приведенных необходимых и достаточных условий: активность, регистрируемая со скальпа, обусловлена относительно мощной суммарной активностью нейронального пула, — логично вытекает положение о том, что суммарная ЭЭГ в первую очередь обусловлена активностью нейронов коры как самых близко расположенных к поверхности кожи головы — месту регистрации.
Ритмические процессы играют ключевую роль в функциональной активности головного мозга.
Неритмическая активность
К неритмической или нерегулярной активности относятся хаотические или стохастические изменения в биоэлектрической активности мозга.
На микроуровне нерегулярную мозговую активность по механизмами можно подразделить на молекулярный, синаптический и 1/f шум,3 и спайковую активность.
Спайки (англ. spikes) также могут быть крайне нерегулярными как во время постоянной, спонтанной активности, так и при вызванной активности при высокой частоте испускания импульсов. Существует неопределенность относительно источника этой нерегулярности, начиная от собственных источников шума в нейронах до коллективных эффектов в крупномасштабных кортикальных сетях. Корковые интернейроны показывают очень нерегулярное время спайка в ответ на введение постоянного тока in vitro. Это резко контрастирует с кортикальными пирамидными клетками, которые проявляют нерегулярную биоэлектрическую активность in vivo, но регулярную in vitro. На записях и вычислительных моделях in vitro показано, что это связано с быстрой кинетикой активации межнейрональных токов ионов К. При этом аритмичный спайк может способствовать нерегулярной активности всей кортикальной сети.45
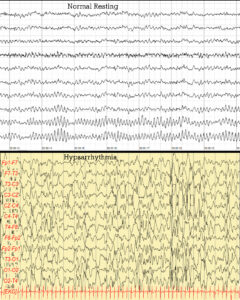
На более высших уровнях организации неритмическая активность может проявляться в виде дезорганизации биоэлектрической активности мозга. Виды дезорганизации:
- Дезорганизация биоэлектрической активности с преобладанием альфа-активности. На ЭЭГ главной является альфа-активность, но она недостаточно регулярная или совсем нерегулярная по частоте. Такой более или менее дезорганизованный альфа-ритм имеет недостаточно высокую амплитуду и может даже доминировать во всех областях мозга. Бета-активность также нередко усилена, часто представлена колебаниями низкой частоты, увеличенной амплитуды. Наряду с этим в ЭЭГ могут присутствовать тета- и дельта-волны с достаточно высокой амплитудой.
- Дезорганизация биоэлектрической активности с преобладанием тета- и дельта-активности. Структуру данного типа характеризует слабая представленность альфа-активности. Колебания биопотенциалов альфа-, бета-, тета- и дельта-диапазонов регистрируются без какой-либо четкой последовательности. Такой бездоминантный тип кривой может иметь как средний, так и высокий амплитудный уровень.
- Гипсаритмия – проявляется как дезорганизация фоновой биоэлектрической активности мозга с нерегулярными медленными волнами высокого напряжения, во время сна могут накладываться мультифокальные пики и полиспайки.6
Пароксизмальная активность
➥ Основная статья: Пароксизмальная активность
Пароксизмы или транзиенты – это короткие интервалы (от 10 до 1000 мс),7 в течение которых сигнал резко изменяется и принимает нетипичный или относительно непредсказуемый характер.
Транзиентная активность отражает функциональную интеграцию структур мозга и является фундаментальным элементом нервного взаимодействия. Транзиенты, порождаемые совместно разными нейронными популяциями говорят о связи этих популяций. Эта связь может быть синхронной или асинхронной.8 Примерами такой активности могут служить спонтанные синхронные синаптические транзиенты, создаваемые токами ионов Са²+между соседними нейронами коры головного мозга.9 Спайки и острые волны, составляющие судорожную или интериктальную активность у лиц с эпилепсией или предрасположенностью к ней, либо транзиенты в виде вертексов и веретена сна, являющиеся нормой. Также с использованием внутриклеточной записи in vivo можно зарегистрировать нерегулярные подпороговые колебания мембранного потенциала и веретенообразные подпороговые колебания мембранного потенциала. ➥ Основная статья:ERP Потенциалы, связанные с событием (ПСС, англ. event-related potential — ERP) представляют собой записанные с кожи головы колебания электрического напряжения, генерируемые в структурах мозга в ответ на определенные события или стимулы. Также относятся к транзиентной мозговой активности. Это изменения ЭЭГ, привязанные ко времени сенсорных, моторных или когнитивных событий, которые обеспечивают безопасный и неинвазивный подход к изучению психофизиологических коррелятов психических процессов. Считается, что они отражают суммарную биоэлектрическую активность постсинаптических потенциалов, возникающих, когда большое количество одинаково ориентированных кортикальных нейронов (порядка тысяч или миллионов) синхронно срабатывают при обработке информации. ERP измеряют при помощи электроэнцефалографии (ЭЭГ) и магнитоэнцефалографии (MEG) . Магнитоэнцефалографическим (MEG) эквивалентом ERP является ERF или поле, связанное с событием (event-related field). 10 К подтипам ERP относятся вызванные и индуцированные потенциалы. ➥ Основная статья: Вызванные потенциалы Когнитивные вызванные потенциалы (ВП, EP) представляют собой связанную с событием активность, которая возникает в виде электрического ответа от мозга на различные типы сенсорной стимуляции нервных тканей; чаще всего используется слуховая и зрительная стимуляция. Регистрация таких электрических потенциалов представляет собой неинвазивный объективный тест, который предоставляет информацию, например, о нарушениях сенсорных путей, локализации поражений, влияющих на сенсорные пути, и расстройств, связанных с языком и речью. Вызванные потенциалы записываются с кожи головы с использованием ЭЭГ. Потенциалы, как правило, проявляют себя как переходная форма волны, морфология которой зависит от типа и силы стимула и расположения электродов на коже головы. Психическое состояние субъекта, например, внимание, бодрствование и ожидание, также влияет на морфологию формы волны. Наряду с вызванной активностью, нейронная активность, связанная со стимулом, может приводить к индуцированной активности. Индуцированный ответ связан с процессами в головном мозге, которые не связаны напрямую со стимулом, а вызваны косвенно нелинейным взаимодействия нейронов после стимула. Функционально компонент индуцированного ответа, вероятно, представляет собой процессы обратной кортико-таламической (top-down) связи, связывающие внешние стимулы с внутренней корковой моделью среды, т. е. объединяющую управляемую извне сенсорную информацию с внутренней мозговой активностью.1112 Индуцированный ответ может быть связан с когнитивными функциями мозга, такими как восприятие, внимание и обучение, которые можно рассматривать как процессы более высокого порядка. Хорошо изученным видом индуцированной активности является изменение амплитуды колебательной активности. Например, гамма-активность часто возрастает во время повышенной умственной активности, как во время представления объекта. Поскольку индуцированные ответы не связаны с фазой, следовательно, будут исключаться при усреднении, то они могут быть получены только с помощью частотно-временного анализа. Индуцированная активность обычно отражает активность многочисленных нейронов: считается, что амплитудные изменения в колебательной активности возникают в результате синхронизации нейронной активности, например, синхронизации времени спайков или флуктуаций мембранного потенциала отдельных нейронов. ➥ Похожая статья: Изменения ЭЭГ Частота биоэлектрической активности может указывать на различные функциональные состояния головного мозга: сон, сознание, познание и некоторые психические расстройства. Снижение биоэлектрической активности может проявляться на ЭЭГ в виде медленных волн, которые чаще всего наблюдаются состояниях, таких как сон, кома,13 смерть мозга, депрессия,14 аутизм,15 опухоли головного мозга, обсессивно-компульсивное расстройство (ОКР),16 синдром дефицита внимания и гиперактивности (СДВГ),17 энцефалит.18 Напротив при повышенной биоэлектрической активности мозга на ЭЭГ отмечаются быстрые волны, при таких состояниях, как эпилепсия,19 беспокойство, посттравматическое стрессовое расстройство (ПТСР) и употребление наркотических средств.20 При этом необходимо отметить, что употребление терминов “снижение” и “повышение” биоэлектрической активности является некорректным, так как биоэлектрическая активность мозга на разных уровнях организации проявляет себя по-разному, и в контексте всего мозга можно лишь оценивать параметры (амплитуду, мощность, индекс) сигналов, полученных при записи ЭЭГ. Затем, опираясь на многочисленные экспериментальные данные можно уже интерпретировать изменения того или иного параметра и говорить о каких-либо изменениях в функциональной активности мозга. По локализации изменения биоэлектрической активности могут быть:21 Характерной особенностью патологической активности при диффузных изменениях биоэлектрической активности являются отсутствие локальности, непостоянство пространственного распределения (мозаичность), нарушение билатеральной синхронии. Диффузное поражение мозга часто связано с развитием энцефалопатии, то есть, распространенного мелкоочагового поражения. Вследствие полиморфизма мелкоочаговых изменений и их распространенности патологические изменения весьма разнообразны и не образуют какой-либо организованной активности, что проявляется мозаичными изменениями биоэлектрической активности головного мозга. При поражении мозга патологические диффузные изменения биоэлектрической активности характеризуются дезорганизацией и отсутствием регулярной доминирующей активности (альфа-ритма). Диффузная патологическая активность может проявляться по-разному (например, в форме медленноволновой ритмики или выявляется эпилептиформная активность), а также иметь различную амплитуду (низкоамплитудная, среднеамплитудная или высокоамплитудная). Дезорганизация биоэлектрической активности, как правило, сопряжена со снижением амплитуды ЭЭГ и отсутствием альфа-ритма, что подробнее описано в статье депрессия альфа-ритма. Дизритмичная активность мозга может проявляться в виде плоской ЭЭГ (III десинхронный тип, рассматривается как пограничная норма), а также с преобладанием альфа-активности (IV дезорганизованный тип) и с преобладанием θ- и δ-активности (V дезорганизованный тип ЭЭГ). Подробнее: классификация нарушений ЭЭГ по типам. Замедление биоэлектрической активности мозга (когда преобладают низкие частоты) не всегда свидетельствует о патологических изменениях и может быть связано с сонливостью. Замедление фоновой ритмики у детей констатируется в зависимости от возрастной группы: Замедление корковой ритмики часто протекает на фоне диффузной дисфункции корковых и подкорковых структур, вследствие сосудистых, метаболических или токсические поражений головного мозга, а у детей может быть следствием перинатальной патологии.Потенциал, связанный с событием
Вызванные потенциалы
Индуцированная активность
Изменения биоэлектрической активности мозга
Классификация изменений БЭА
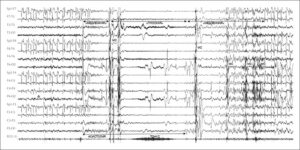
Диффузные изменения ЭЭГ
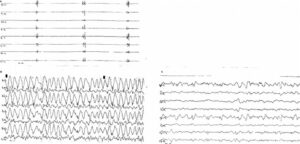
Дезорганизация ЭЭГ
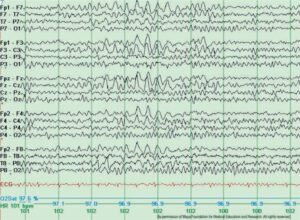
Замедление мозговой активности
Читайте также
Footnotes
doi: 10.1007/978-0-387-79020-6